学术动态
北京大学尹玉新团队揭示肿瘤免疫逃逸新机制
作者:尹玉新 来源自:中国免疫学会 点击数:47531 发布时间:2020-06-10
2020年1月13日,北京大学系统生物医学研究所尹玉新教授团队在国际免疫学领域顶级期刊Nature Immunology在线发表题为The phosphatase PAC1 acts as a T cell suppressor and attenuates host antitumor immunity的成果,首次报道PAC1作为免疫系统负调控因子,特异性抑制T淋巴细胞防御功能,促进肿瘤免疫逃逸。
恶性肿瘤发展和转移是与机体免疫系统相互博弈的结果。肿瘤细胞可以通过诱导T淋巴细胞功能耗竭,从而逃辟免疫细胞的攻击。尽管通过PD-1抗体治疗,部分阻断T淋巴细胞功能耗竭,在肿瘤免疫治疗中取得较好的疗效,但是只有不到20%的患者对PD-1抗体治疗有反应。和血液系统肿瘤不同,实体瘤的肿瘤微环境仍然是目前肿瘤免疫治疗领域的难关和研究重点。由此可见,探索肿瘤影响T淋巴细胞功能的机制,明确T淋巴细胞在肿瘤微环境中缘何发生功能耗竭,对鉴定肿瘤免疫新靶点,研发有效的肿瘤治疗新策略有重要意义。
尹玉新团队通过对肿瘤微环境中的炎症因子和代谢物进行多组学分析,发现肿瘤中ROS的累积对维持周围浸润T淋巴细胞中PAC1基因的表达是必需的。进一步的机制研究显示,ROS通过激活转录因子EGR1的活性,从而促进PAC1分子的转录和表达。
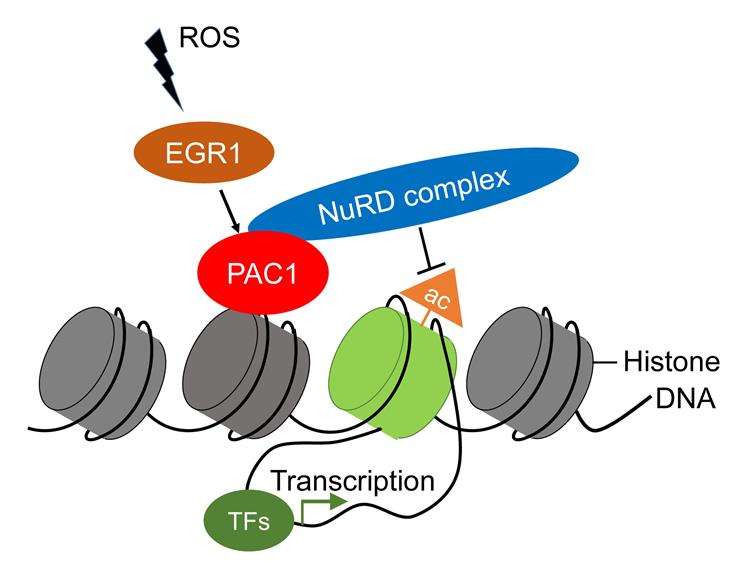
本次研究发现PAC1在功能耗竭的T淋巴细胞中特异性高水平表达。临床研究发现,PAC1表达越高的肿瘤患者,其的预后较差。进一步研究显示, PAC1抑制CD8+ T细胞对肿瘤细胞的杀伤功能,诱发耗竭性T淋巴细胞的形成,促进肿瘤免疫逃逸和转移。在机制方面,PAC1通过招募核小体重构和去乙酰化(NuRD)复合体,重塑T细胞的染色质开放性,影响下游效应性基因的表达,最终限制的T淋巴细胞介导的肿瘤杀伤功能。
综上所述,PAC1作为重要的T淋巴细胞功能抑制因子,可以减弱宿主免疫监视功能,促进肿瘤免疫逃逸。而抑制PAC1通路,可以激活T淋巴细胞的防御功能。因此,该研究为肿瘤免疫治疗提供了潜在的新型药物靶点。
北京大学基础医学院的吕丹副研究员和博士后刘亮为该论文的共同第一作者,北京大学系统生物医学研究所尹玉新教授为通讯作者。该项研究获得国家重点研发计划、国家自然科学基金、北京市自然科学基金、北京大学医学部青年学者培养基金和中国博士后科学基金等项目的资助。
文章链接:https://www.nature.com/articles/s41590-019-0577-9
恶性肿瘤发展和转移是与机体免疫系统相互博弈的结果。肿瘤细胞可以通过诱导T淋巴细胞功能耗竭,从而逃辟免疫细胞的攻击。尽管通过PD-1抗体治疗,部分阻断T淋巴细胞功能耗竭,在肿瘤免疫治疗中取得较好的疗效,但是只有不到20%的患者对PD-1抗体治疗有反应。和血液系统肿瘤不同,实体瘤的肿瘤微环境仍然是目前肿瘤免疫治疗领域的难关和研究重点。由此可见,探索肿瘤影响T淋巴细胞功能的机制,明确T淋巴细胞在肿瘤微环境中缘何发生功能耗竭,对鉴定肿瘤免疫新靶点,研发有效的肿瘤治疗新策略有重要意义。
尹玉新团队通过对肿瘤微环境中的炎症因子和代谢物进行多组学分析,发现肿瘤中ROS的累积对维持周围浸润T淋巴细胞中PAC1基因的表达是必需的。进一步的机制研究显示,ROS通过激活转录因子EGR1的活性,从而促进PAC1分子的转录和表达。

ROS-EGR1-PAC1信号通路参与诱导T淋巴细胞功能耗竭
本次研究发现PAC1在功能耗竭的T淋巴细胞中特异性高水平表达。临床研究发现,PAC1表达越高的肿瘤患者,其的预后较差。进一步研究显示, PAC1抑制CD8+ T细胞对肿瘤细胞的杀伤功能,诱发耗竭性T淋巴细胞的形成,促进肿瘤免疫逃逸和转移。在机制方面,PAC1通过招募核小体重构和去乙酰化(NuRD)复合体,重塑T细胞的染色质开放性,影响下游效应性基因的表达,最终限制的T淋巴细胞介导的肿瘤杀伤功能。
综上所述,PAC1作为重要的T淋巴细胞功能抑制因子,可以减弱宿主免疫监视功能,促进肿瘤免疫逃逸。而抑制PAC1通路,可以激活T淋巴细胞的防御功能。因此,该研究为肿瘤免疫治疗提供了潜在的新型药物靶点。
北京大学基础医学院的吕丹副研究员和博士后刘亮为该论文的共同第一作者,北京大学系统生物医学研究所尹玉新教授为通讯作者。该项研究获得国家重点研发计划、国家自然科学基金、北京市自然科学基金、北京大学医学部青年学者培养基金和中国博士后科学基金等项目的资助。
文章链接:https://www.nature.com/articles/s41590-019-0577-9
