学术动态
姚煦/李巍/李潇团队合作揭示人朗格汉斯细胞亚群在发育和功能上的异质性
作者:刘笑纯 来源自:中国免疫学会 点击数:19838 发布时间:2021-11-12
朗格汉斯细胞 (LC) 是皮肤内最主要的抗原呈递细胞,在维持皮肤稳态中发挥关键作用。LC一方面参与激活免疫反应,另一方面通过诱导调节性T细胞(Treg)发挥抗炎效应,因此人们一直推测LC具有不同亚群。近年来研究揭示了小鼠LC具有卵黄囊和单核细胞等多种起源,在表型和功能上兼具巨噬细胞和树突状细胞的双重特征,进一步提示LC的异质性。
2021年9月10日,中国医学科学院皮肤病医院姚煦教授团队和复旦大学附属华山医院李巍教授团队合作在Immunity杂志在线发表题为“Distinct human Langerhans cell subsets orchestrate reciprocal functions and require different developmental regulation”的研究论文,首次揭示了具有不同表型的人LC亚群,并系统研究了不同LC亚群的发育分化途径,以及不同LC亚群的免疫应答差异和在银屑病皮损中的表型和功能改变。
在该项研究中,研究人员综合单细胞转录组测序技术(scRNA-seq)、质谱流式细胞技术和常规流式细胞技术,在人表皮原代LC和脐带血CD34+造血干细胞衍生的LC(HSC-LC)中发现LC的四个亚群:稳定状态的LC1 (CD207hiCD1ahiCD1clo/-)和LC2 (CD207intCD1aintCD1chi),以及激活状态的活化LC(aLC)和迁移LC(migLC)。进一步分析差异基因和功能富集通路发现,LC1具备经典LC的特征,主要与固有免疫和抗原加工相关;LC2与单核细胞或髓样树突细胞相似,参与免疫反应和白细胞的激活;aLC和migLC不同程度地表达成熟和迁移相关分子CD83和CCR7,代表发生活化并开始向真皮迁移的LC亚群。
研究团队通过分析HSC-LC不同分化时间点的scRNA-seq数据,描绘出完整的LC发育分化轨迹。基于LC转录调控图谱,利用慢病毒感染沉默特异基因表达,或者利用小分子抑制剂干预,进一步验证了调控各亚群分化的关键分子。SPI1和ID2是在时间序列上顺序调节LC发育的关键转录因子,NF-κB通路参与LC活化的负向调节。LC1和LC2分别由相应的前体细胞发育而来,EGR1和Notch信号调节是调控从前体细胞向两亚群分化的关键途径。
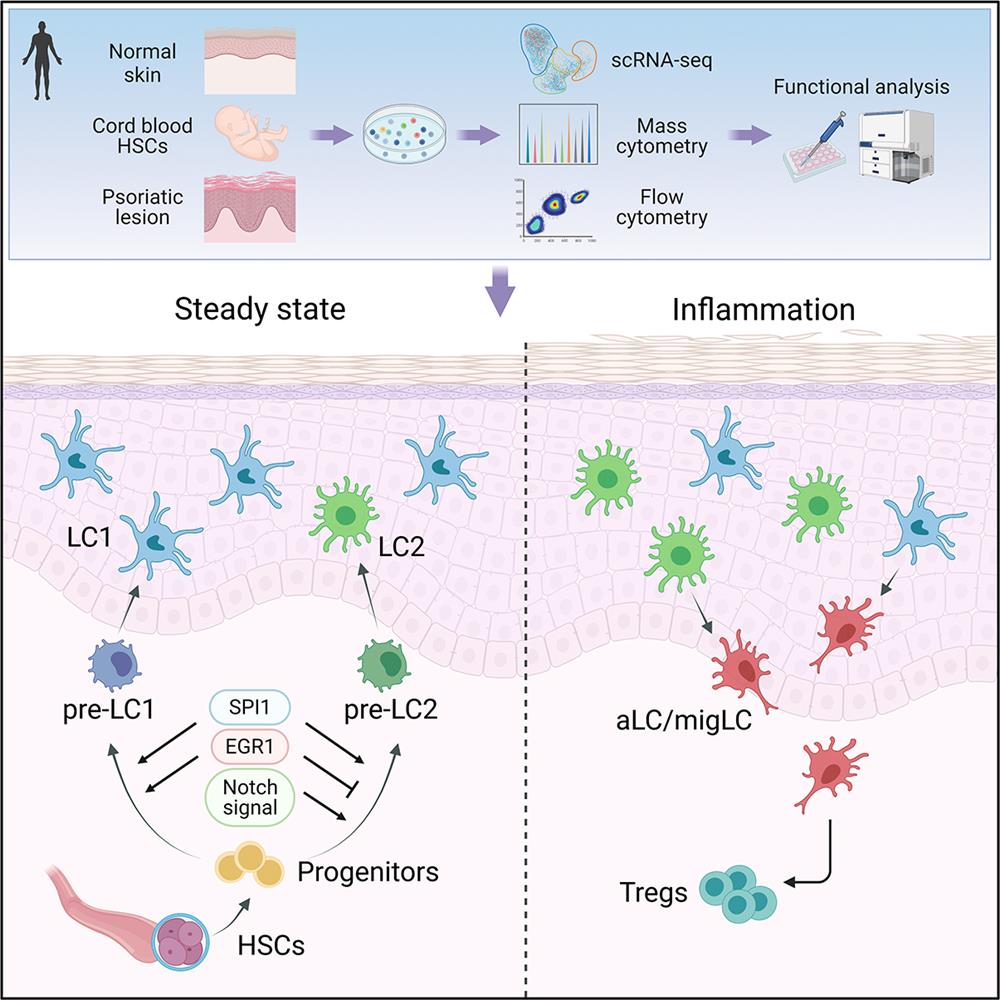
体外功能研究发现,LC1和LC2协同互补,共同维持并调节皮肤免疫稳态。LC1作为经典的“效应LC”,具有较强的自我更新能力和抗原摄取功能,在炎症微环境中保持稳定;LC2具有较强的迁移能力,更好地抵御γ射线损伤,在炎症刺激下容易被激活,表达高水平的免疫抑制分子PD-L1和RANK,诱导Treg细胞分化的能力强,可以被认为是“调节性 LC”。作者进一步研究了LC亚群在银屑病皮损中的变化,结合对以往文献scRNA-seq数据的分析,通过质谱流式和常规流式技术验证,发现银屑病患者皮损较健康皮肤中LC2和 aLC/migLC 的比例升高,PD-1+ T细胞和CD4+Foxp3+ Treg细胞数量增多。LC和T细胞之间通过RANKL-RANK和PD-L1/PD-1/CD80轴调节皮肤的炎症应答。
该研究利用人皮肤原代LC和HSC衍生的LC,首次全面系统地描绘了人类LC在表型和功能上的异质性,揭示了LC的分化轨迹以及关键调控分子,阐明了不同LC亚群在静息和疾病状态下的功能差异。
中国医学科学院皮肤病医院刘笑纯博士和华山医院朱容慧博士是该文章的共同第一作者,美国德克萨斯州心脏研究所李潇研究员负作为共同通讯作者,深圳清华研究生院刘晓教授作为文章的Senior author。该工作还得到了华东师范大学赖玉平教授、复旦大学附属儿科医院周玉峰教授和台湾国立健康研究院黄啸谷教授的支持。
原文链接:https://doi.org/10.1016/j.immuni.2021.08.012
2021年9月10日,中国医学科学院皮肤病医院姚煦教授团队和复旦大学附属华山医院李巍教授团队合作在Immunity杂志在线发表题为“Distinct human Langerhans cell subsets orchestrate reciprocal functions and require different developmental regulation”的研究论文,首次揭示了具有不同表型的人LC亚群,并系统研究了不同LC亚群的发育分化途径,以及不同LC亚群的免疫应答差异和在银屑病皮损中的表型和功能改变。
在该项研究中,研究人员综合单细胞转录组测序技术(scRNA-seq)、质谱流式细胞技术和常规流式细胞技术,在人表皮原代LC和脐带血CD34+造血干细胞衍生的LC(HSC-LC)中发现LC的四个亚群:稳定状态的LC1 (CD207hiCD1ahiCD1clo/-)和LC2 (CD207intCD1aintCD1chi),以及激活状态的活化LC(aLC)和迁移LC(migLC)。进一步分析差异基因和功能富集通路发现,LC1具备经典LC的特征,主要与固有免疫和抗原加工相关;LC2与单核细胞或髓样树突细胞相似,参与免疫反应和白细胞的激活;aLC和migLC不同程度地表达成熟和迁移相关分子CD83和CCR7,代表发生活化并开始向真皮迁移的LC亚群。
研究团队通过分析HSC-LC不同分化时间点的scRNA-seq数据,描绘出完整的LC发育分化轨迹。基于LC转录调控图谱,利用慢病毒感染沉默特异基因表达,或者利用小分子抑制剂干预,进一步验证了调控各亚群分化的关键分子。SPI1和ID2是在时间序列上顺序调节LC发育的关键转录因子,NF-κB通路参与LC活化的负向调节。LC1和LC2分别由相应的前体细胞发育而来,EGR1和Notch信号调节是调控从前体细胞向两亚群分化的关键途径。

体外功能研究发现,LC1和LC2协同互补,共同维持并调节皮肤免疫稳态。LC1作为经典的“效应LC”,具有较强的自我更新能力和抗原摄取功能,在炎症微环境中保持稳定;LC2具有较强的迁移能力,更好地抵御γ射线损伤,在炎症刺激下容易被激活,表达高水平的免疫抑制分子PD-L1和RANK,诱导Treg细胞分化的能力强,可以被认为是“调节性 LC”。作者进一步研究了LC亚群在银屑病皮损中的变化,结合对以往文献scRNA-seq数据的分析,通过质谱流式和常规流式技术验证,发现银屑病患者皮损较健康皮肤中LC2和 aLC/migLC 的比例升高,PD-1+ T细胞和CD4+Foxp3+ Treg细胞数量增多。LC和T细胞之间通过RANKL-RANK和PD-L1/PD-1/CD80轴调节皮肤的炎症应答。
该研究利用人皮肤原代LC和HSC衍生的LC,首次全面系统地描绘了人类LC在表型和功能上的异质性,揭示了LC的分化轨迹以及关键调控分子,阐明了不同LC亚群在静息和疾病状态下的功能差异。
中国医学科学院皮肤病医院刘笑纯博士和华山医院朱容慧博士是该文章的共同第一作者,美国德克萨斯州心脏研究所李潇研究员负作为共同通讯作者,深圳清华研究生院刘晓教授作为文章的Senior author。该工作还得到了华东师范大学赖玉平教授、复旦大学附属儿科医院周玉峰教授和台湾国立健康研究院黄啸谷教授的支持。
原文链接:https://doi.org/10.1016/j.immuni.2021.08.012
