学术动态
张学敏/李涛合作组《Nat Immunol》发文发现cGAS关键调控机制
作者:李涛 来源自:中国免疫学会 点击数:15271 发布时间:2019-01-04
2018年12月3日,《Nature Immunology》杂志发表了国家生物医学分析中心张学敏院士课题组和李涛课题组的最新研究成果《G3BP1 promotes DNA binding and activation of cGAS》。该工作发现了胞质DNA感受器cGAS复合物的重要组成部分G3BP1,并揭示了其在cGAS介导的抗病毒天然免疫反应中的关键作用及其调控机理。
病原体感染时,会将其DNA带入宿主细胞,并引发强烈免疫反应。2013年美国科学家陈志坚教授鉴定发现cGAS是胞内DNA的关键感受器。相关研究进一步揭示,除了感受病毒入侵以外,cGAS的异常激活直接导致了一类自身免疫疾病的发生,如AGS综合征、系统性红斑狼疮等。因此,研究cGAS激活的调控机制并发展干预策略,有望为控制病毒感染和自身免疫性疾病的治疗带来新的突破。
研究人员首先通过质谱鉴定到cGAS的相互作用蛋白质G3BP1 (GTPase- activating protein SH3 domain–binding protein 1)。利用G3BP1基因敲除细胞,研究人员发现缺失G3BP1对多种DNA-cGAS诱导的I型干扰素产生都有明显抑制作用,表明G3BP1对cGAS的激活具有关键调控作用。cGAS作为环二核苷酸合成酶,其合成产物cGAMP可以指示其酶活性的变化。该研究发现敲除G3BP1显著抑制cGAMP的合成,但不影响cGAMP诱导的下游信号通路激活,提示G3BP1可能通过调控cGAS活性影响I型干扰素的产生。
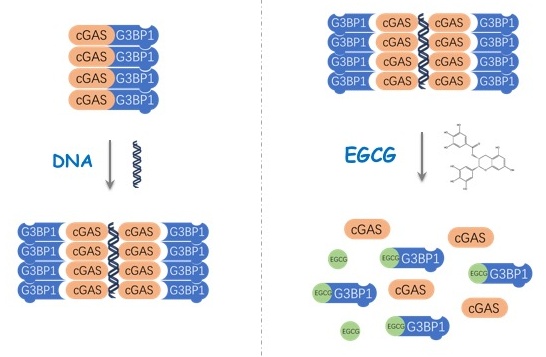
利用体外cGAMP合成实验及DNA结合实验等,研究人员进一步发现G3BP1能明显增强cGAS对DNA的识别并促进cGAS酶活性。深入的机制研究揭示G3BP1通过帮助cGAS形成多聚物保证了cGAS能够高效地识别DNA。
更重要的是,在此基础上研究人员进一步发现了一种来自绿茶的天然小分子化合物EGCG(Epigallocatechin gallate)能够干扰G3BP1与cGAS的结合,进而抑制cGAS活性。利用自身免疫疾病动物模型和AGS病人细胞,研究人员验证了EGCG在体内抑制cGAS的有效性。
该研究发现了机体抗病毒感染的一个关键分子机制,并为cGAS相关的自身免疫疾病提供了潜在的治疗策略。
病原体感染时,会将其DNA带入宿主细胞,并引发强烈免疫反应。2013年美国科学家陈志坚教授鉴定发现cGAS是胞内DNA的关键感受器。相关研究进一步揭示,除了感受病毒入侵以外,cGAS的异常激活直接导致了一类自身免疫疾病的发生,如AGS综合征、系统性红斑狼疮等。因此,研究cGAS激活的调控机制并发展干预策略,有望为控制病毒感染和自身免疫性疾病的治疗带来新的突破。
研究人员首先通过质谱鉴定到cGAS的相互作用蛋白质G3BP1 (GTPase- activating protein SH3 domain–binding protein 1)。利用G3BP1基因敲除细胞,研究人员发现缺失G3BP1对多种DNA-cGAS诱导的I型干扰素产生都有明显抑制作用,表明G3BP1对cGAS的激活具有关键调控作用。cGAS作为环二核苷酸合成酶,其合成产物cGAMP可以指示其酶活性的变化。该研究发现敲除G3BP1显著抑制cGAMP的合成,但不影响cGAMP诱导的下游信号通路激活,提示G3BP1可能通过调控cGAS活性影响I型干扰素的产生。

利用体外cGAMP合成实验及DNA结合实验等,研究人员进一步发现G3BP1能明显增强cGAS对DNA的识别并促进cGAS酶活性。深入的机制研究揭示G3BP1通过帮助cGAS形成多聚物保证了cGAS能够高效地识别DNA。
更重要的是,在此基础上研究人员进一步发现了一种来自绿茶的天然小分子化合物EGCG(Epigallocatechin gallate)能够干扰G3BP1与cGAS的结合,进而抑制cGAS活性。利用自身免疫疾病动物模型和AGS病人细胞,研究人员验证了EGCG在体内抑制cGAS的有效性。
该研究发现了机体抗病毒感染的一个关键分子机制,并为cGAS相关的自身免疫疾病提供了潜在的治疗策略。
