学术动态
梁启明团队《Nat Immunol》发文报道NLRP1炎症小体的非经典激活方式
作者:梁启明 来源自:中国免疫学会 点击数:5863 发布时间:2022-07-06
在机体受到病原微生物感染或损伤性刺激时会产生一种多蛋白复合物称为炎症小体,在受到外界刺激时,胞质内的受体蛋白(receptor)会被激活并招募下游ASC和caspase1形成炎症小体,并使caspase1通过自切割的方式活化。活化后的caspase1会切割IL-1β、IL-18前体和GSDMD,产生成熟的IL-1β和IL-18并诱导细胞焦亡(Pyroptosis)。NLRP1是NOD样受体家族中第一个被发现可以与ASC和caspase1形成复合体的蛋白,NLRP1 FIIND结构域可自发部分水解,产生NLRP1NT和NLRP1CT两条多肽链。其中,NLRP1CT具有形成炎症小体的活性,NLRP1CT能够与NLRP1NT及未被切割的全长NLRP1FL形成自抑制体,抑制其自身的活性。目前普遍认为NLRP1炎症小体会通过经典的NLRP1NT功能性降解(Functional degradation)激活。炭疽杆菌(Bacillus anthracis)的致死因子LF(lethal factor)切割并且降解鼠源NLRP1bNT,释放活化的NLRP1bCT进而组装炎症小体;肠道病毒编码的蛋白水解酶(3C Protease)切割人源NLRP1NT并导致其降解,从而激活炎症小体。最新研究发现,NLRP1与DPP9形成2:1的复合体结构(NLRP1FL-DPP9-NLRP1CT)能够抑制NLRP1CT的激活。VbP,DPP8/9的抑制剂,能够抑制此NLRP1FL-DPP9-NLRP1CT复合体的形成,并导致炎症小体的激活。除此之外,目前是否有其他能够激活NLRP1炎症小体的方式尚不清楚。
课题组发现KSHV感染可以诱导炎症小体的组装和激活,且该激活方式并不依赖于病毒DNA和细胞DNA受体IFI16的识别,而是由KSHV病毒中的一种名为ORF45的蛋白直接激活胞内的炎症小体,诱导炎症因子IL-1β的产生和细胞焦亡。研究团队通过酵母双杂交实验鉴定人源NLRP1是ORF45激活炎症小体的受体,在细胞中敲除NLRP1可以抑制KSHV感染或ORF45表达所诱导的炎症小体激活,敲除ORF45的 KSHV(KSHV△ORF45)同样不能诱导炎症小体的激活。进一步研究发现,位于PYD与NACHT结构域之间的Linker1区域对人源NLRP1自抑制体的形成至关重要,Linker1通过与NLRP1CT的UPA结构域结合,能够限制NLRP1CT的活化。ORF45会通过与Linker1结合,竞争性抑制NLRP1NT与NLRP1CT的互作,使活化的NLRP1CT能够在细胞质中与ASC和caspase1组装成炎症小体(图),并且NLRP1NT与ORF45在激活的过程中能够从细胞质迁移到细胞核中,并不发生经典的功能性降解。同时ORF45对NLRP1的激活在灵长类中非常保守。ORF45不影响NLRP1与DPP9之间的结合,VbP也不影响ORF45对NLRP1的激活。
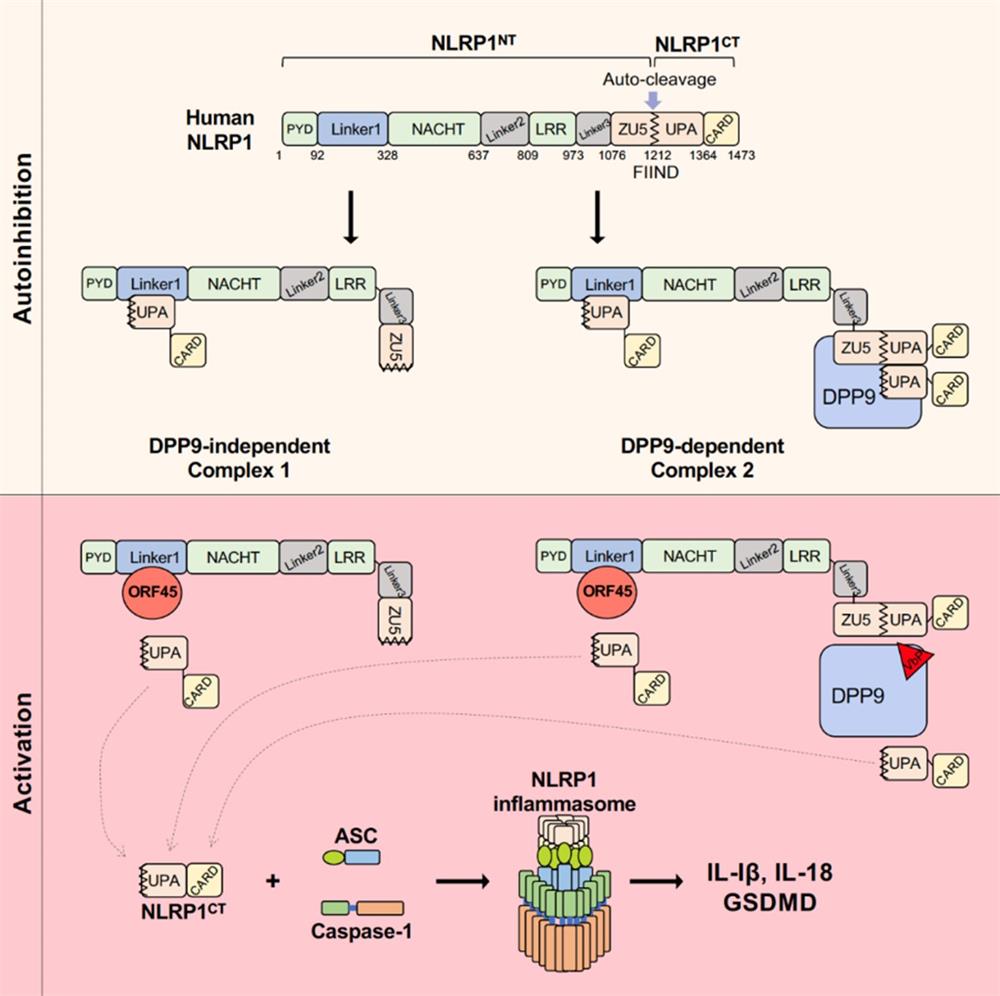
综上所述,在KSHV感染的过程中,细胞中的NOD样受体NLRP1能够通过识别病毒的ORF45结构蛋白进行炎症小体的激活,从而诱发炎症反应。这种激活方式仅依赖于PYD与NACHT结构域之间的Linker1区域对ORF45的识别,而不是经典的功能性降解途径,也无需细胞因子DPP9的参与。
该研究揭示了一种全新的NLRP1对于炎症小体的不依赖NLRP1NT降解的非经典激活途径,丰富了人们对于NLRP1自抑制和活化的调控机制的认知范畴,重新定义了人源NLRP1的两个自抑制体的存在模式和作用机制,阐明了由于病毒的结构蛋白而非病毒DNA是使KSHV激活炎症小体的主要配体。
上海市免疫学研究所杨星、周景璠和刘成容为本研究论文的共同第一作者,通讯作者为上海市免疫学研究所的梁启明研究员。该研究工作得到了上海交通大学医学院,上海市免疫学研究所,瑞金免疫与疾病研究中心,国家自然科学基金委员会,国家重点研发计划,上海市科学技术委员会,“细胞稳态调控与疾病”前沿科学中心和上海市地方高水平大学协同创新团队等平台及经费的支持。北京生命科学研究所邵峰院士和佛罗里达州立大学Fanxiu Zhu教授对本研究论文提供帮助。
课题组发现KSHV感染可以诱导炎症小体的组装和激活,且该激活方式并不依赖于病毒DNA和细胞DNA受体IFI16的识别,而是由KSHV病毒中的一种名为ORF45的蛋白直接激活胞内的炎症小体,诱导炎症因子IL-1β的产生和细胞焦亡。研究团队通过酵母双杂交实验鉴定人源NLRP1是ORF45激活炎症小体的受体,在细胞中敲除NLRP1可以抑制KSHV感染或ORF45表达所诱导的炎症小体激活,敲除ORF45的 KSHV(KSHV△ORF45)同样不能诱导炎症小体的激活。进一步研究发现,位于PYD与NACHT结构域之间的Linker1区域对人源NLRP1自抑制体的形成至关重要,Linker1通过与NLRP1CT的UPA结构域结合,能够限制NLRP1CT的活化。ORF45会通过与Linker1结合,竞争性抑制NLRP1NT与NLRP1CT的互作,使活化的NLRP1CT能够在细胞质中与ASC和caspase1组装成炎症小体(图),并且NLRP1NT与ORF45在激活的过程中能够从细胞质迁移到细胞核中,并不发生经典的功能性降解。同时ORF45对NLRP1的激活在灵长类中非常保守。ORF45不影响NLRP1与DPP9之间的结合,VbP也不影响ORF45对NLRP1的激活。

综上所述,在KSHV感染的过程中,细胞中的NOD样受体NLRP1能够通过识别病毒的ORF45结构蛋白进行炎症小体的激活,从而诱发炎症反应。这种激活方式仅依赖于PYD与NACHT结构域之间的Linker1区域对ORF45的识别,而不是经典的功能性降解途径,也无需细胞因子DPP9的参与。
该研究揭示了一种全新的NLRP1对于炎症小体的不依赖NLRP1NT降解的非经典激活途径,丰富了人们对于NLRP1自抑制和活化的调控机制的认知范畴,重新定义了人源NLRP1的两个自抑制体的存在模式和作用机制,阐明了由于病毒的结构蛋白而非病毒DNA是使KSHV激活炎症小体的主要配体。
上海市免疫学研究所杨星、周景璠和刘成容为本研究论文的共同第一作者,通讯作者为上海市免疫学研究所的梁启明研究员。该研究工作得到了上海交通大学医学院,上海市免疫学研究所,瑞金免疫与疾病研究中心,国家自然科学基金委员会,国家重点研发计划,上海市科学技术委员会,“细胞稳态调控与疾病”前沿科学中心和上海市地方高水平大学协同创新团队等平台及经费的支持。北京生命科学研究所邵峰院士和佛罗里达州立大学Fanxiu Zhu教授对本研究论文提供帮助。
