学术动态
清华大学董晨教授在《Immunity》报道微RNA对Th17细胞的调控机制
6月21日,清华大学免疫学研究所董晨教授在《Immunity》杂志在线发表了题为“The MicroRNA-183-96-182 Cluster Promotes T Helper 17 Cell Pathogenicity by Negatively Regulating Transcription Factor Foxo1 Expression”的研究论文,发现了微RNA Mir-183C 在致病性Th17 细胞发育及功能中的重要作用,并阐明了其中的分子机制。本文的第一作者是Kenji Ichiyama,原为董晨教授的博士后,现任日本大阪大学助理教授;董晨教授以及来自斯克里普斯研究所的肖长春博士是本文的共同通讯作者;其它合作单位包括得克萨斯大学 MD 安德森癌症中心等。
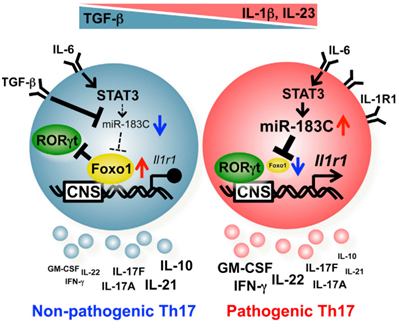
辅助T细胞17(T Helper 17 Cells,简称Th17)是一种董晨教授等发现的辅助T细胞亚型,主要分泌白细胞介素17,Th17被发现在自身免疫与炎症疾病的发生过程中发挥重要的作用。董晨实验室发现并鉴定Th17 细胞特性和在各类疾病中的致病作用,促进了Th17 领域的快速发展。有研究发现miRNAs调控TGF-beta和IL-6介导的Th17细胞分化。然而,miRNAs在IL-6、IL-1和IL-23通路诱导的致病性Th17细胞中的功能仍然不清楚。
由于miRNAs的缺陷严重影响了Th17细胞的发育,在这篇文章中,董晨教授领导的研究团队在成熟的Th17细胞中选择性敲除miRNA功能,并发现该小鼠对Th17细胞依赖的自身免疫疾病模型EAE(实验性自身免疫性脑脊髓炎)产生耐受,证实了miRNAs在Th17细胞致病性中的重要作用。通过全基因组分析技术,该团队进一步发现Mir-183C在致病性Th17细胞中特异性高表达并在其发育及功能具有重要作用。相应的,Mir-183C的表达被IL-6-STAT3信号通路诱导,并可被IL-1和IL-23进一步上调,然而TGF-beta对其有显著的抑制作用。在机制上,Mir-183C主要通过抑制转录因子FOXO1的水平来发挥作用。FOXO1蛋白抑制IL-1R的表达,从而下调Th17细胞用以介导EAE的关键炎症因子如IL-17A和GM-CSF等。因此,Mir-183C的缺失可通过上调FOXO1导致IL-1R表达下降,进而抑制Th17细胞的致病性,导致EAE耐受。
这项研究表明,Mir-183C通过抑制转录因子FOXO1的表达促进了致病性Th17细胞的发育。该研究为深入了解miRNAs在致病性Th17细胞参与的机体免疫和相关疾病中的作用提供了重要的研究成果。
文章链接:http://www.cell.com/immunity/fulltext/S1074-7613(16)30203-5
董晨教授,现任清华大学医学院教授,医学院常务副院长,清华大学免疫学研究所所长。其实验室致力于T淋巴细胞的相关研究,在Tfh和Tfr细胞的发现和研究中,做出了开创性贡献。董晨教授是Th17细胞分化、调节和功能研究领域的奠基者和研究权威之一。目前已发表论文190余篇,总被引用次数达18000余次,2009年被美国免疫学家协会授予BD Bioscience 研究者奖,2011年被选为美国科学促进会会士,并于2014年和2015年连续两次被汤森路透评为全球高被引科学家。
