学术动态
厦门大学陈兰芬教授与周大旺教授研究团队揭示TH17细胞和Treg细胞分化发育调控的新机制
近日,厦门大学生命科学学院陈兰芬教授与周大旺教授研究团队在研究辅助性T细胞(TH17)和调节性T细胞(Treg)的分化发育与功能调控方面取得重要进展。相关研究成果以封面文章发表于国际免疫学顶级学术期刊Nature immunology(2017 Jul;18(7):800-812.)上,标题为“The transcriptional coactivator TAZ regulates reciprocal differentiation of TH17 cells and Tregcells”。
陈兰芬教授与周大旺教授研究团队长期从事Hippo信号通路在免疫功能调控和肿瘤发生发展中的作用研究。该团队的前期研究发现小鼠中Hippo信号通路中激酶Mst1/2缺失导致免疫缺陷,机体易受病原体感染并伴随着严重自身免疫疾病。随后,法国与德国研究人员发现一种人类家族遗传性的免疫缺陷及自身免疫病综合征是由于Mst1基因功能缺失突变造成的。2015年,该研究团队发现和报道了Mst1/2缺失导致吞噬细胞的线粒体无法募集到吞噬体周边导致损伤性ROS产生缺陷,从而导致机体病原体杀伤能力下降的重要机理(Nature immunology,2015 Nov;16(11):1142-52.封面文章)。
在这项最新的研究中,该团队发现Hippo信号通路下游主要的转录共激活因子TAZ在决定CD4+初始T细胞分化为促进炎症的TH17效应细胞和抑制免疫反应的Treg调节性细胞过程中发挥着关键作用。该团队应用CyTOF2质谱流式细胞仪,针对Hippo信号通路关键成员在T细胞特异性敲除小鼠,利用KLH模型分析发现,与野生型小鼠相比Mst1/2敲除后TH17细胞亚群数量显著上升与之相对应的Treg细胞亚群大量减少;而当被Mst1/2抑制的下游效应分子TAZ敲除后,这两类亚群细胞数量呈现相反的变化。进一步研究发现,在CD4+初始T细胞分化为TH17效应细胞和Treg细胞过程中TAZ表达量显著上调。机体内促炎症的TH17细胞和抑制炎症Treg细胞在类群数量和活化状态的失衡是造成自身免疫疾病的主要致病因素,通过分析临床类风湿性关节炎和干燥综合征病人的外周血记忆性T细胞也发现TAZ的表达量与TH17细胞的核心转录因子RORγt的表达呈正相关。结果表明TAZ的大量表达对于促进TH17细胞的分化及其介导的炎症性疾病的发生十分重要。生化和分子生物学手段进一步研究后发现,多聚化的TAZ能够同时与TH17细胞的核心转录因子RORγt和Treg细胞关键转录因子Foxp3形成复合物,TAZ能够促进RORγt转录活性但抑制Foxp3的功能,从而促进TH17细胞的分化和减弱Treg细胞的产生。该研究同时还发现在初始T细胞分化为Treg细胞时,Hippo信号通路下游主要转录因子TEAD1的表达量明显上升,由于TEAD1与TAZ高亲和结合,从而竞争性阻断了TAZ与RORγt或Foxp3的相互作用,继而增强了初始T细胞分化为Treg细胞的能力。该研究阐明了TAZ在调节CD4+初始T细胞分化为TH17细胞和Treg细胞的过程中发挥着关键调控作用的分子机制,也证明了Hippo信号通路在免疫系统稳态调控中的重要作用。研究成果对多种自身免疫性疾病的发病机理提供理论依据,也为早期诊断和治疗慢性炎症性疾病提供可能的分子标志物和治疗靶标。
该项研究入选当期封面文章,并被Nature Immunology(2017 ;18(7):709-711), Nature Reviews Rheumatology(2017;13, 389)杂志作为亮点进行评论。这项研究工作获得了国家自然科学基金委、国家重点基础研究发展计划(“973”项目)、“青年千人计划”和中央高校基本科研基金的资助。厦门大学陈兰芬教授与周大旺教授为通讯作者,博士后耿晶、博士生余淑娟、赵昊和孙秀峰为共同第一作者,并与厦门大学附属第一医院、浙江大学、美国德克萨斯大学等单位合作完成。
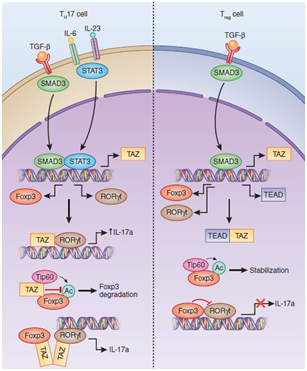
转录共激活因子TAZ调节TH17和Treg细胞分化的分子机制
(from Nat Immunol.2017 ;18(7):709-711)
Abstract: An imbalance in the lineages of immunosuppressive regulatory T cells (Treg cells) and the inflammatory TH17 subset of helper T cells leads to the development of autoimmune and/or inflammatory disease. Drs. Lanfen Chen and Dawang Zhou of Xiamen University reported that TAZ, a coactivator of TEAD transcription factors of Hippo signaling, was expressed under TH17 cell-inducing conditions and was required for TH17 differentiation and TH17 cell-mediated inflammatory diseases. TAZ was a critical co-activator of the TH17-defining transcription factor RORγt. In addition, TAZ attenuated Treg cell development by decreasing acetylation of the Tregcell master regulator Foxp3 mediated by the histone acetyltransferase Tip60, which targeted Foxp3 for proteasomal degradation. In contrast, under Treg cell-skewing conditions, TEAD1 expression and sequestration of TAZ from the transcription factors RORγt and Foxp3 promoted Treg cell differentiation. Furthermore, deficiency in TAZ or overexpression of TEAD1 induced Treg cell differentiation, whereas expression of a transgene encoding TAZ or activation of TAZ directed TH17 cell differentiation. These results demonstrate a pivotal role for TAZ in regulating the differentiation of Treg cells and TH17 cells. This study suggested that TAZ might be useful as a diagnostic marker and a therapeutic target for some Th17/Treg disorder related autoimmune diseases.
