学术动态
刘新东团队《Science》揭示Tfh细胞通过分泌SOSTDC1促进Tfr细胞分化
作者:刘鑫 来源自:中国免疫学会 点击数:56192 发布时间:2021-01-18
伴随着生发中心反应,一类由胸腺来源的nTreg细胞分化形成滤泡调节性T细胞(follicular regulatory T cell, Tfr)能够负向调控体液免疫的中心轴“滤泡辅助性T细胞(follicular helper T cell, Tfh)–B细胞–抗体”。Tfr细胞不仅可以维持正常体液免疫应答,还能防止抗体介导的自身免疫性疾病发生。然而,nTreg如何分化成Tfr细胞在领域内尚不清楚。
近日,陆军军医大学第一附属医院刘新东教授团队发现Tfh细胞分化形成新亚群,命名为SOSTDC1+Tfh细胞。与传统Tfh细胞功能不同,新型SOSTDC1+Tfh细胞丢失辅助B细胞产生抗体的功能,其通过分泌蛋白SOSTDC1促进Tfr细胞分化,负反馈调节生发中心反应。研究者发现Tfh细胞特异性高表达SOSTDC1,并形成特定的细胞亚型SOSTDC1+Tfh。SOSTDC1主要在T–B细胞边界区域的Tfh细胞和成纤维网状基质细胞中表达。采用单细胞转录组测序分析发现SOSTDC1+Tfh新亚型是由SOSTDC1–Tfh细胞分化生成。SOSTDC1+Tfh细胞与经典的Tfh细胞功能不同,它不能帮助B细胞产生抗体。在Sostdc1–/–小鼠的流感病毒感染模型以及特异性抗原免疫模型中,发现敲除SOSTDC1能增强生发中心反应:伴随着生发中心B细胞数目增多,Tfr细胞数目明显减少。进一步采用骨髓移植构建嵌合体小鼠,发现Tfh细胞来源的SOSTDC1能够促进Tfr细胞分化。
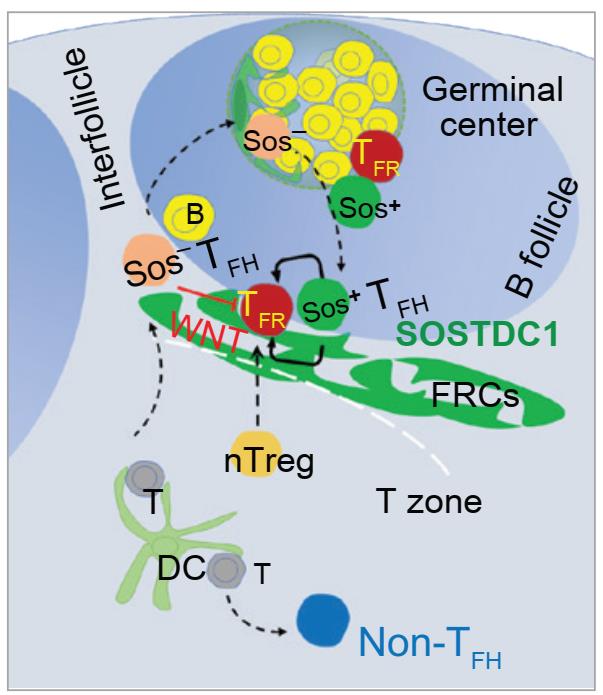
进一步探究SOSTDC1促进Tfr细胞分化的分子机制,通过转录组分析发现,SOSTDC1–Tfh细胞表达大量的WNT配体基因,而SOSTDC1+Tfh细胞表达拮抗WNT信号的基因。通过对SOSTDC1敲除情况下的Tfr细胞分析,发现受损Tfr细胞呈现炎性细胞特征:大量表达IL-4、IL-5和IL-6等炎性细胞因子,同时Tfr细胞表现为WNT/β-catenin信号通路过度激活,表明Tfh可通过SOSTDC1促进Tfr细胞分化。
上述研究“SOSTDC1-producing follicular helper T cells promote regulatory follicular T cell differentiation”于 2020年8月21日发表在Science(《科学》)杂志。该研究率先发现Tfh细胞的新亚群并定义为SOSTDC1+Tfh细胞,阐明其通过促进Tfr细胞分化,负反馈调控抗体产生。这一发现不仅为疫苗研发策略提供了理论依据,还为自身免疫性疾病的药物研发、提高抗病毒感染策略提供新视角。
陆军军医大学第一附属医院病理科刘新东教授、卞修武院士和王岩教授为本研究的通讯作者。陆军军医大学第一附属医院病理科吴鑫博士为该论文的第一作者。
原文链接:https://science.sciencemag.org/content/369/6506/984
近日,陆军军医大学第一附属医院刘新东教授团队发现Tfh细胞分化形成新亚群,命名为SOSTDC1+Tfh细胞。与传统Tfh细胞功能不同,新型SOSTDC1+Tfh细胞丢失辅助B细胞产生抗体的功能,其通过分泌蛋白SOSTDC1促进Tfr细胞分化,负反馈调节生发中心反应。研究者发现Tfh细胞特异性高表达SOSTDC1,并形成特定的细胞亚型SOSTDC1+Tfh。SOSTDC1主要在T–B细胞边界区域的Tfh细胞和成纤维网状基质细胞中表达。采用单细胞转录组测序分析发现SOSTDC1+Tfh新亚型是由SOSTDC1–Tfh细胞分化生成。SOSTDC1+Tfh细胞与经典的Tfh细胞功能不同,它不能帮助B细胞产生抗体。在Sostdc1–/–小鼠的流感病毒感染模型以及特异性抗原免疫模型中,发现敲除SOSTDC1能增强生发中心反应:伴随着生发中心B细胞数目增多,Tfr细胞数目明显减少。进一步采用骨髓移植构建嵌合体小鼠,发现Tfh细胞来源的SOSTDC1能够促进Tfr细胞分化。

进一步探究SOSTDC1促进Tfr细胞分化的分子机制,通过转录组分析发现,SOSTDC1–Tfh细胞表达大量的WNT配体基因,而SOSTDC1+Tfh细胞表达拮抗WNT信号的基因。通过对SOSTDC1敲除情况下的Tfr细胞分析,发现受损Tfr细胞呈现炎性细胞特征:大量表达IL-4、IL-5和IL-6等炎性细胞因子,同时Tfr细胞表现为WNT/β-catenin信号通路过度激活,表明Tfh可通过SOSTDC1促进Tfr细胞分化。
上述研究“SOSTDC1-producing follicular helper T cells promote regulatory follicular T cell differentiation”于 2020年8月21日发表在Science(《科学》)杂志。该研究率先发现Tfh细胞的新亚群并定义为SOSTDC1+Tfh细胞,阐明其通过促进Tfr细胞分化,负反馈调控抗体产生。这一发现不仅为疫苗研发策略提供了理论依据,还为自身免疫性疾病的药物研发、提高抗病毒感染策略提供新视角。
陆军军医大学第一附属医院病理科刘新东教授、卞修武院士和王岩教授为本研究的通讯作者。陆军军医大学第一附属医院病理科吴鑫博士为该论文的第一作者。
原文链接:https://science.sciencemag.org/content/369/6506/984
