学术动态
李华兵团队等合作发现tRNA-m1A修饰是CD4 T细胞增殖调控的新型翻译“检查点”
作者:李华兵 来源自:中国免疫学会 点击数:16210 发布时间:2022-10-12
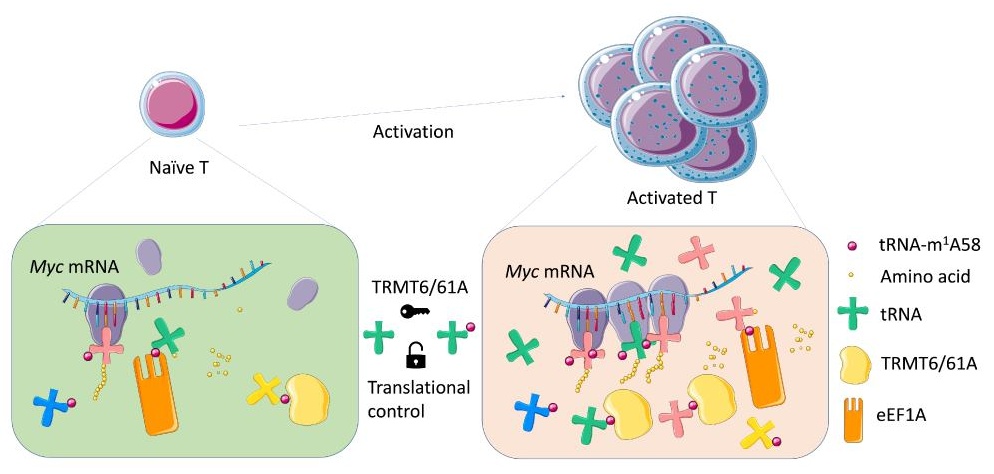
2022年 9 月 22日,上海交通大学医学院上海市免疫学研究所李华兵研究员及合作团队在Nature Immunology杂志上发表了题为“tRNA-m1A modification promotes T cell expansion via efficient MYC protein synthesis”的研究论文,该研究揭示了m1A修饰催化酶tRNA methyltransferase 61A(TRMT61A)通过催化新合成tRNA第58位腺嘌呤的甲基化(m1A),来提高CD4+ T细胞激活后多种关键蛋白的翻译效率,进而促进CD4+ T细胞的快速增殖。
Naïve CD4+ T细胞在接受不同抗原信号刺激时,可被激活并退出静息状态,随后开始大量克隆扩增,并最终分化成为辅助性CD4+ T细胞亚群,广泛参与多种免疫应答进程并发挥相应调控作用。鉴于CD4+ T细胞的重要性,探索不同辅助性CD4+ T细胞亚群发育及功能一直是领域内的研究重点。Naïve CD4+ T细胞从静息状态维持—早期激活—扩增—效应功能发挥等不同阶段是否可以受到不同RNA化学修饰的精细调控,从而保持免疫稳态以及T细胞的正常功能,一直是李华兵团队的主要研究方向。
为了明确CD4+ T细胞激活早期细胞内各种基因表达的动态变化,该团队通过综合分析多组学测序结果,锚定了tRNA上第58位腺嘌呤的甲基化修饰(m1A58)的合成酶—TRMT61A,构建了T细胞中特异性敲除TRMT61A的缺陷鼠,开展了一系列体内外生物学研究。发现m1A58合成酶TRMT61A的缺失会显著降低T细胞在激活后早期应激基因的翻译效率,导致CD4+ T细胞快速扩增受阻,从而在小鼠过继转输性结肠炎模型中表现为可减轻CD4+ T细胞介导的肠炎,并且这一过程部分依赖于对转录因子MYC的翻译调控。tRNA的作用、tRNA的修饰和密码子使用的选择性等研究在T细胞领域极少涉及,这项工作首次将tRNA修饰与T细胞的功能变化连接起来,系统性地探究了CD4+ T细胞扩增过程中控制翻译进程的具体机制,表明tRNA的使用及其修饰可以显著影响CD4+ T细胞功能。区别于李华兵研究员以往阐明的METTL3介导的m6A修饰是CD4+ T细胞激活的“刹车解除”功能(Nature 2017),这项研究表明TRMT61A介导的tRNA-m1A58修饰可作为CD4+ T细胞增殖调控的新型“翻译检查点”,将为临床上改造CD4+ T细胞功能提供一种新的RNA表观遗传调控策略。
同期Nature Immunology杂志专门配发了Research Briefing, 其中‘Expert opinion’高度评价了改论文的新颖性和重要意义,认为该文首次研究了tRNA修饰与T细胞功能的机制,为领域带来了免疫细胞转录后调控的全新认识;‘From the editor’总结该文研究的科学问题类似于Naïve T细胞激活后如何像一辆跑车在2秒内从0加速到60英里/小时,发现m1A tRNA修饰是类似于‘跑车油门’的翻译检查点来驱动T细胞的快速增值。鉴于该文的新颖性和重要性,同期的Nature Immunology杂志还还同时配发了News & Views,邀请专家对该文的研究结果以及意义进行了详细解读。
本研究工作得到国家自然科学基金、国家科技部、上海市科委等项目的资助。上海交通大学医学院上海市免疫学研究所刘永波、周静副研究员和硕士研究生施金彤、浙江大学医学院李笑雨研究员、北京大学生命科学学院博士研究生张晓婷为本论文的共同第一作者;上海交通大学医学院上海市免疫学研究所李华兵研究员、重庆国际免疫研究院吴玉章教授、北京大学生命科学学院伊成器教授及耶鲁大学医学院Richard Flavell教授为该文的共同通讯作者。
李华兵博士于2017年8月正式入职上海交通大学医学院上海市免疫学研究所/上海交通大学医学院基础医学院免疫学与微生物学系担任课题组长,建立RNA表观免疫课题组。最近五年的相关研究成果以通讯(含共同通讯)作者发表在国际权威杂志Nature Immunology、PNAS、Cell Research、Science Advances(3篇)、Nature Communications、Molecular Cancer和Nature、Immunity、Cell Reports等一系列杂志上。作为项目负责人主持国家自然科学基金委国际合作与交流项目(2021)、重点项目(2020)、面上项目(2020)、重大研究计划培育项目(2017)、两项上海市“科技创新行动计划”项目(2020),获得科技部重点研发计划子课题资助,并入选国家高层次海外人才青年项目(2017)和上海市“东方学者”特聘教授等人才项目。李华兵课题组近年来深入系统地研究RNA修饰如何调控免疫细胞的功能以及在肠道炎症和肿瘤发生发展中的作用,欢迎优秀人才(包括博士后和技术员)加入团队共同推进课题进展,课题组将为拟加入的成员提供上海地区具有竞争力的待遇、一流的研究平台和良好的发展前景。课题组更多详情参考实验室网页:https://hua-binglilab.com。
李华兵团队一直聚焦探索RNA修饰对免疫细胞发育及功能影响的研究,尤其侧重对T细胞RNA表观遗传调控的探索,发表了系列高水平研究成果,形成了一定的学术影响力。在这篇最新发表在Nature Immunology的工作中,李华兵团队及合作者们利用最新的技术采集和分析了多维度的数据,包括RNA-seq、tRNA-seq、m1A-seq、Ribotag-seq及蛋白质组学结果,发现naïve CD4+ T细胞由激活到扩增阶段细胞会次序上调不同的tRNA species, 从而保证迅速上调细胞增殖所需的蛋白水平。这一过程中新合成的大量tRNAs依赖于TRMT61A介导的tRNA第58位腺嘌呤的甲基化修饰(m1A58)来增强其对应增殖相关基因的翻译效率。这篇研究首次将tRNA修饰的机制和T细胞功能联系起来,有力地解释了CD4+ T细胞这类需要在应对TCR刺激时迅速发挥效应的免疫细胞如何依赖tRNA的表观遗传修饰影响细胞内的翻译机制,进而保障CD4+ T细胞在激活扩增时免疫应答的迅速性与充分性。这个工作也是tRNA修饰改变调控细胞功能的一个非常有代表性的例子。
这篇论文是李华兵博士继2017年Nature论文首次展示m6A小鼠生理功能后,又一次利用免疫T细胞体系揭示了RNA修饰的重要性。考虑到近年来m6A修饰在各种生理体系研究中已取得了一系列百家争鸣、百花争艳的研究进展,这项m1A修饰在T细胞中的首创性研究有可能引领新的研究热潮,让我们拭目以待。
论文链接:https://www.nature.com/articles/s41590-022-01301-3
Research Briefing: https://www.nature.com/articles/s41590-022-01302-2
News & Views: https://www.nature.com/articles/s41590-022-01317-9
Naïve CD4+ T细胞在接受不同抗原信号刺激时,可被激活并退出静息状态,随后开始大量克隆扩增,并最终分化成为辅助性CD4+ T细胞亚群,广泛参与多种免疫应答进程并发挥相应调控作用。鉴于CD4+ T细胞的重要性,探索不同辅助性CD4+ T细胞亚群发育及功能一直是领域内的研究重点。Naïve CD4+ T细胞从静息状态维持—早期激活—扩增—效应功能发挥等不同阶段是否可以受到不同RNA化学修饰的精细调控,从而保持免疫稳态以及T细胞的正常功能,一直是李华兵团队的主要研究方向。
为了明确CD4+ T细胞激活早期细胞内各种基因表达的动态变化,该团队通过综合分析多组学测序结果,锚定了tRNA上第58位腺嘌呤的甲基化修饰(m1A58)的合成酶—TRMT61A,构建了T细胞中特异性敲除TRMT61A的缺陷鼠,开展了一系列体内外生物学研究。发现m1A58合成酶TRMT61A的缺失会显著降低T细胞在激活后早期应激基因的翻译效率,导致CD4+ T细胞快速扩增受阻,从而在小鼠过继转输性结肠炎模型中表现为可减轻CD4+ T细胞介导的肠炎,并且这一过程部分依赖于对转录因子MYC的翻译调控。tRNA的作用、tRNA的修饰和密码子使用的选择性等研究在T细胞领域极少涉及,这项工作首次将tRNA修饰与T细胞的功能变化连接起来,系统性地探究了CD4+ T细胞扩增过程中控制翻译进程的具体机制,表明tRNA的使用及其修饰可以显著影响CD4+ T细胞功能。区别于李华兵研究员以往阐明的METTL3介导的m6A修饰是CD4+ T细胞激活的“刹车解除”功能(Nature 2017),这项研究表明TRMT61A介导的tRNA-m1A58修饰可作为CD4+ T细胞增殖调控的新型“翻译检查点”,将为临床上改造CD4+ T细胞功能提供一种新的RNA表观遗传调控策略。
同期Nature Immunology杂志专门配发了Research Briefing, 其中‘Expert opinion’高度评价了改论文的新颖性和重要意义,认为该文首次研究了tRNA修饰与T细胞功能的机制,为领域带来了免疫细胞转录后调控的全新认识;‘From the editor’总结该文研究的科学问题类似于Naïve T细胞激活后如何像一辆跑车在2秒内从0加速到60英里/小时,发现m1A tRNA修饰是类似于‘跑车油门’的翻译检查点来驱动T细胞的快速增值。鉴于该文的新颖性和重要性,同期的Nature Immunology杂志还还同时配发了News & Views,邀请专家对该文的研究结果以及意义进行了详细解读。

TRMT61A介导的tRNA-m1A58修饰是促进CD4+ T细胞增殖的翻译“检查点”
本研究工作得到国家自然科学基金、国家科技部、上海市科委等项目的资助。上海交通大学医学院上海市免疫学研究所刘永波、周静副研究员和硕士研究生施金彤、浙江大学医学院李笑雨研究员、北京大学生命科学学院博士研究生张晓婷为本论文的共同第一作者;上海交通大学医学院上海市免疫学研究所李华兵研究员、重庆国际免疫研究院吴玉章教授、北京大学生命科学学院伊成器教授及耶鲁大学医学院Richard Flavell教授为该文的共同通讯作者。
李华兵博士于2017年8月正式入职上海交通大学医学院上海市免疫学研究所/上海交通大学医学院基础医学院免疫学与微生物学系担任课题组长,建立RNA表观免疫课题组。最近五年的相关研究成果以通讯(含共同通讯)作者发表在国际权威杂志Nature Immunology、PNAS、Cell Research、Science Advances(3篇)、Nature Communications、Molecular Cancer和Nature、Immunity、Cell Reports等一系列杂志上。作为项目负责人主持国家自然科学基金委国际合作与交流项目(2021)、重点项目(2020)、面上项目(2020)、重大研究计划培育项目(2017)、两项上海市“科技创新行动计划”项目(2020),获得科技部重点研发计划子课题资助,并入选国家高层次海外人才青年项目(2017)和上海市“东方学者”特聘教授等人才项目。李华兵课题组近年来深入系统地研究RNA修饰如何调控免疫细胞的功能以及在肠道炎症和肿瘤发生发展中的作用,欢迎优秀人才(包括博士后和技术员)加入团队共同推进课题进展,课题组将为拟加入的成员提供上海地区具有竞争力的待遇、一流的研究平台和良好的发展前景。课题组更多详情参考实验室网页:https://hua-binglilab.com。
专家点评
何川 教授(芝加哥大学)李华兵团队一直聚焦探索RNA修饰对免疫细胞发育及功能影响的研究,尤其侧重对T细胞RNA表观遗传调控的探索,发表了系列高水平研究成果,形成了一定的学术影响力。在这篇最新发表在Nature Immunology的工作中,李华兵团队及合作者们利用最新的技术采集和分析了多维度的数据,包括RNA-seq、tRNA-seq、m1A-seq、Ribotag-seq及蛋白质组学结果,发现naïve CD4+ T细胞由激活到扩增阶段细胞会次序上调不同的tRNA species, 从而保证迅速上调细胞增殖所需的蛋白水平。这一过程中新合成的大量tRNAs依赖于TRMT61A介导的tRNA第58位腺嘌呤的甲基化修饰(m1A58)来增强其对应增殖相关基因的翻译效率。这篇研究首次将tRNA修饰的机制和T细胞功能联系起来,有力地解释了CD4+ T细胞这类需要在应对TCR刺激时迅速发挥效应的免疫细胞如何依赖tRNA的表观遗传修饰影响细胞内的翻译机制,进而保障CD4+ T细胞在激活扩增时免疫应答的迅速性与充分性。这个工作也是tRNA修饰改变调控细胞功能的一个非常有代表性的例子。
这篇论文是李华兵博士继2017年Nature论文首次展示m6A小鼠生理功能后,又一次利用免疫T细胞体系揭示了RNA修饰的重要性。考虑到近年来m6A修饰在各种生理体系研究中已取得了一系列百家争鸣、百花争艳的研究进展,这项m1A修饰在T细胞中的首创性研究有可能引领新的研究热潮,让我们拭目以待。
论文链接:https://www.nature.com/articles/s41590-022-01301-3
Research Briefing: https://www.nature.com/articles/s41590-022-01302-2
News & Views: https://www.nature.com/articles/s41590-022-01317-9
