学术动态
曹雪涛团队《Cell》发文揭示磷酸化修饰介导的IFN-γR2细胞膜转位促进巨噬细胞的活化
作者:许小青 来源自:中国免疫学会 点击数:23484 发布时间:2018-12-11
2018年11月15日,《Cell》杂志刊登了中国免疫学会秘书长曹雪涛院士研究团队的论文《Phosphorylation-mediated IFN-γR2 membrane translocation is required to activate macrophage innate response》,报道了黏附因子E-selectin通过细胞外的作用机制活化酪氨酸激酶BTK,BTK磷酸化IFN-γR2的第289位的酪氨酸,磷酸化的IFN-γR2与钙离子结合蛋白EFhd2,促进了IFN-γR2从高尔基体到细胞膜的转运过程,促进了天然免疫反应中巨噬细胞的活化。
IFN-γ在天然免疫和适应性免疫中发挥了重要的功能,在病原微生物的清除,特别是胞内细菌,如李斯特细菌和结核杆菌的清除发挥重要的调控作用。IFN-γ在抗肿瘤免疫反应中也具有非常重要的作用,研究发现IFN-γ活化的信号通路与肿瘤免疫监测点治疗的疗效密切相关。IFN-γ是通过与表达在细胞膜上的IFN-γR结合从而激活JAK/STAT通路。 IFN-γR由α(IFN-γR1)和β亚基(IFN-γR2)构成,已有研究证实IFN-γR1在细胞膜上为组成型表达,此亚基能够与IFN-γ结合,而IFN-γR2承担传递信号的功能。IFN-γR1和IFN-γR2的异常表达与MSMD(Mendelian susceptibility to mycobacterial disease)密切相关,此疾病的特征是患者发生局部的或者弥漫性的非典型分支杆菌的感染。目前已经发现MSMD中IFN-γR2的多个突变位点,这些突变会导致IFN-γR2在细胞膜上的完全或者部分缺失,从而导致免疫功能缺陷。在不同免疫细胞中,IFN-γR2在细胞膜上的表达具有差异性,在巨噬细胞和B细胞的细胞膜上高表达IFN-γR2,而IFN-γR2在活化的Th1细胞的细胞膜上表达量很低,因此IFN-γR2在细胞膜上的表达受到严格的调控但其调控机制仍不清楚。在巨噬细胞膜上高表达的IFN-γR2可以促进IFN-γ介导的巨噬细胞的活化,进而诱导被感染的巨噬细胞的凋亡。活化的Th1细胞的细胞膜上低表达IFN-γR2可以使其避免凋亡。目前认为配体依赖及配体非依赖性IFN-γR2内吞是调控其在Th1细胞膜上低表达,但是在巨噬细胞膜高表达IFN-γR2的调控机制了解甚少。因此阐明IFN-γR2在巨噬细胞中的动态调控过程具有重要的理论意义和应用价值。
免疫细胞在趋化因子的作用下通过血管运输到炎症部位,而细胞游出血管是发挥其功能的关键步骤,在此过程中,通过血管上皮细胞表面的黏附分子与免疫细胞的膜蛋白的相互作用,完成免疫细胞自血管的游出过程。E-selectin表达在血管内皮细胞,也表达在骨髓的微环境的内皮细胞。炎症发生时,E-selectin在TNF-α和IL6等炎性因子的作用下,诱导性表达在细胞膜上,从而介导免疫细胞自血管的游出到炎症部位。
曹雪涛课题组的许小青博士、许佳博士等在研究中偶然发现Sele基因敲除(Sele-/-)小鼠抵抗胞内细菌LM(李斯特菌)的能力显著下降,进一步研究发现Sele-/-小鼠的巨噬细胞活化能力也明显受到抑制。然而,我们在Sele-/-小鼠的血清中检测到的高水平的IFN-γ。同时发现在Sele-/-巨噬细胞中, JAK/STAT通路的活化显著降低。上述结果使我们推测,敲除Sele基因可能影响了巨噬细胞膜表面IFN-γR的表达。通过FACS和IF证实IFN-γR2在Sele-/-巨噬细胞的膜表面表达显著下降,而IFN-γR1的膜表达没有显著变化。进一步研究发现E-selectin主要调控CCR2+巨噬细胞(炎性巨噬细胞,也称迁移性巨噬细胞)膜表面IFN-γR2的表达。上述结果表明血管上皮的E-selectin调控了自血管游出的巨噬细胞的IFN-γR2膜表达,进而调控了巨噬细胞的活化。qRT-PCR检测确定Sele mRNA在巨噬细胞中不表达,因此证实E-selectin是通过细胞外机制调控IFN-γR2在巨噬细胞膜表面的表达。通过Sele-/-巨噬细胞与重组的E-selectin蛋白的共孵育和造血干细胞移植实验进一步证实细胞外的E-selectin调控IFN-γR2在巨噬细胞膜表面的表达。同时还发现E-selectin也调控了IL2Rβ和TRL4在巨噬细胞膜表面的表达,因此表明E-selectin对于受体在细胞膜上的表达调控具有广泛性。
表达在细胞膜上的受体是调控细胞生物学功能的门户,受体通过与配体的结合激活细胞内的信号通路,进而调控细胞的生物学活性。受体在细胞膜上的表达是一个复杂的动态过程,包括受体蛋白的合成,修饰,运输,内吞,再循环及降解等过程,参与的细胞器或者亚细胞结构包括内质网,高尔基复合体,内体,溶酶体等。通过RT-PCR和Western blot证实在敲除Sele基因的巨噬细胞中,Ifngr2 mRNA和IFN-γR2蛋白水平并没有降低。进一步通过共聚焦显微镜分析IFN-γR2蛋白与RAB5, RAB11, RAB7的共定位、细胞器分离检测和生物素标记细胞膜蛋白技术,证实E-selectin不是通过调控IFN-γR2的合成、内吞、再循环和降解等途径影响其在巨噬细胞膜上的表达。通过IB检测分离的高尔基体和共聚焦显微镜分析证实IFN-γR2蛋白聚集在Sele-/-巨噬细胞的高尔基体中。
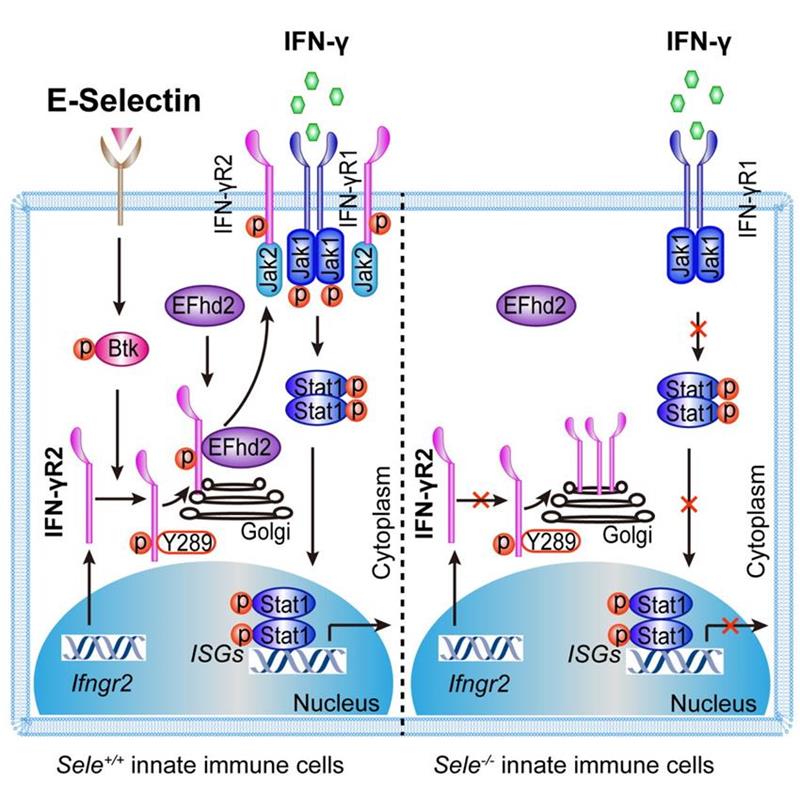 进一步的机制研究表明,E-selectin信号通路中的酪氨酸激酶SYK和BTK的活化在Sele-/-巨噬细胞中显著下降。通过BTK特异性抑制剂和Btk敲除小鼠LM感染模型证实,此酪氨酸激酶在巨噬细胞膜表面表达IFN-γR2过程中具有重要的调控作用。通过免疫共沉淀实验,我们发现BTK和IFN-γR2能够相互结合。共聚焦显微镜和免疫电镜证实IFN-γR2突变体IFN-γR2 Y289A积聚在293T的高尔基体中,体外激酶实验表明BTK能够磷酸化IFN-γR2的第289位的酪氨酸。通过coIP和质谱检测发现钙离子结合蛋白EFhd2与IFN-γR2相互作用。在巨噬细胞中干扰或者在小鼠中敲除Efhd2基因后,巨噬细胞IFN-γR2的膜表达显著下降。进一步研究发现IFN-γR2 Y289的磷酸化能够促进IFN-γR2和EFhd2的结合,因此促进IFN-γR2自高尔基体向细胞膜的转位。
进一步的机制研究表明,E-selectin信号通路中的酪氨酸激酶SYK和BTK的活化在Sele-/-巨噬细胞中显著下降。通过BTK特异性抑制剂和Btk敲除小鼠LM感染模型证实,此酪氨酸激酶在巨噬细胞膜表面表达IFN-γR2过程中具有重要的调控作用。通过免疫共沉淀实验,我们发现BTK和IFN-γR2能够相互结合。共聚焦显微镜和免疫电镜证实IFN-γR2突变体IFN-γR2 Y289A积聚在293T的高尔基体中,体外激酶实验表明BTK能够磷酸化IFN-γR2的第289位的酪氨酸。通过coIP和质谱检测发现钙离子结合蛋白EFhd2与IFN-γR2相互作用。在巨噬细胞中干扰或者在小鼠中敲除Efhd2基因后,巨噬细胞IFN-γR2的膜表达显著下降。进一步研究发现IFN-γR2 Y289的磷酸化能够促进IFN-γR2和EFhd2的结合,因此促进IFN-γR2自高尔基体向细胞膜的转位。
该研究表明血管上皮的E-selectin通过与巨噬细胞膜上的配体结合激活BTK分子,BTK对IFN-γR2 Y289磷酸化,促进IFN-γR2与EFhd2的结合,进而促进IFN-γR2从高尔基体到细胞膜的转运过程。我们的研究对于细胞因子受体的膜表面表达过程提供新的视角,并且对于治疗感染性疾病,自身免疫性疾病和肿瘤免疫提供了潜在的作用靶点。
IFN-γ在天然免疫和适应性免疫中发挥了重要的功能,在病原微生物的清除,特别是胞内细菌,如李斯特细菌和结核杆菌的清除发挥重要的调控作用。IFN-γ在抗肿瘤免疫反应中也具有非常重要的作用,研究发现IFN-γ活化的信号通路与肿瘤免疫监测点治疗的疗效密切相关。IFN-γ是通过与表达在细胞膜上的IFN-γR结合从而激活JAK/STAT通路。 IFN-γR由α(IFN-γR1)和β亚基(IFN-γR2)构成,已有研究证实IFN-γR1在细胞膜上为组成型表达,此亚基能够与IFN-γ结合,而IFN-γR2承担传递信号的功能。IFN-γR1和IFN-γR2的异常表达与MSMD(Mendelian susceptibility to mycobacterial disease)密切相关,此疾病的特征是患者发生局部的或者弥漫性的非典型分支杆菌的感染。目前已经发现MSMD中IFN-γR2的多个突变位点,这些突变会导致IFN-γR2在细胞膜上的完全或者部分缺失,从而导致免疫功能缺陷。在不同免疫细胞中,IFN-γR2在细胞膜上的表达具有差异性,在巨噬细胞和B细胞的细胞膜上高表达IFN-γR2,而IFN-γR2在活化的Th1细胞的细胞膜上表达量很低,因此IFN-γR2在细胞膜上的表达受到严格的调控但其调控机制仍不清楚。在巨噬细胞膜上高表达的IFN-γR2可以促进IFN-γ介导的巨噬细胞的活化,进而诱导被感染的巨噬细胞的凋亡。活化的Th1细胞的细胞膜上低表达IFN-γR2可以使其避免凋亡。目前认为配体依赖及配体非依赖性IFN-γR2内吞是调控其在Th1细胞膜上低表达,但是在巨噬细胞膜高表达IFN-γR2的调控机制了解甚少。因此阐明IFN-γR2在巨噬细胞中的动态调控过程具有重要的理论意义和应用价值。
免疫细胞在趋化因子的作用下通过血管运输到炎症部位,而细胞游出血管是发挥其功能的关键步骤,在此过程中,通过血管上皮细胞表面的黏附分子与免疫细胞的膜蛋白的相互作用,完成免疫细胞自血管的游出过程。E-selectin表达在血管内皮细胞,也表达在骨髓的微环境的内皮细胞。炎症发生时,E-selectin在TNF-α和IL6等炎性因子的作用下,诱导性表达在细胞膜上,从而介导免疫细胞自血管的游出到炎症部位。
曹雪涛课题组的许小青博士、许佳博士等在研究中偶然发现Sele基因敲除(Sele-/-)小鼠抵抗胞内细菌LM(李斯特菌)的能力显著下降,进一步研究发现Sele-/-小鼠的巨噬细胞活化能力也明显受到抑制。然而,我们在Sele-/-小鼠的血清中检测到的高水平的IFN-γ。同时发现在Sele-/-巨噬细胞中, JAK/STAT通路的活化显著降低。上述结果使我们推测,敲除Sele基因可能影响了巨噬细胞膜表面IFN-γR的表达。通过FACS和IF证实IFN-γR2在Sele-/-巨噬细胞的膜表面表达显著下降,而IFN-γR1的膜表达没有显著变化。进一步研究发现E-selectin主要调控CCR2+巨噬细胞(炎性巨噬细胞,也称迁移性巨噬细胞)膜表面IFN-γR2的表达。上述结果表明血管上皮的E-selectin调控了自血管游出的巨噬细胞的IFN-γR2膜表达,进而调控了巨噬细胞的活化。qRT-PCR检测确定Sele mRNA在巨噬细胞中不表达,因此证实E-selectin是通过细胞外机制调控IFN-γR2在巨噬细胞膜表面的表达。通过Sele-/-巨噬细胞与重组的E-selectin蛋白的共孵育和造血干细胞移植实验进一步证实细胞外的E-selectin调控IFN-γR2在巨噬细胞膜表面的表达。同时还发现E-selectin也调控了IL2Rβ和TRL4在巨噬细胞膜表面的表达,因此表明E-selectin对于受体在细胞膜上的表达调控具有广泛性。
表达在细胞膜上的受体是调控细胞生物学功能的门户,受体通过与配体的结合激活细胞内的信号通路,进而调控细胞的生物学活性。受体在细胞膜上的表达是一个复杂的动态过程,包括受体蛋白的合成,修饰,运输,内吞,再循环及降解等过程,参与的细胞器或者亚细胞结构包括内质网,高尔基复合体,内体,溶酶体等。通过RT-PCR和Western blot证实在敲除Sele基因的巨噬细胞中,Ifngr2 mRNA和IFN-γR2蛋白水平并没有降低。进一步通过共聚焦显微镜分析IFN-γR2蛋白与RAB5, RAB11, RAB7的共定位、细胞器分离检测和生物素标记细胞膜蛋白技术,证实E-selectin不是通过调控IFN-γR2的合成、内吞、再循环和降解等途径影响其在巨噬细胞膜上的表达。通过IB检测分离的高尔基体和共聚焦显微镜分析证实IFN-γR2蛋白聚集在Sele-/-巨噬细胞的高尔基体中。

该研究表明血管上皮的E-selectin通过与巨噬细胞膜上的配体结合激活BTK分子,BTK对IFN-γR2 Y289磷酸化,促进IFN-γR2与EFhd2的结合,进而促进IFN-γR2从高尔基体到细胞膜的转运过程。我们的研究对于细胞因子受体的膜表面表达过程提供新的视角,并且对于治疗感染性疾病,自身免疫性疾病和肿瘤免疫提供了潜在的作用靶点。
