学术动态
西湖大学徐和平团队发现嗜酸性粒细胞介导神经信号调节小肠粘膜免疫力
作者:徐和平 来源自:中国免疫学会 点击数:19983 发布时间:2023-09-15
2023年9月15日,西湖大学徐和平课题组于Science杂志发表题为"Neuromedin U programs eosinophils to promote mucosal immunity of the small intestine"的研究论文。研究成果揭示了肠道神经系统信号可直接调控嗜酸性粒细胞的活性进而调节小肠上皮细胞稳态和粘膜免疫力。
粒细胞是一种异质性白细胞,其包括中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞。粒细胞是天然免疫细胞,其特征是胞浆中存在分泌性细胞毒性颗粒,并且为多形核。粒细胞中数量最多的是中性粒细胞,其次是嗜酸性粒细胞。与其他粒细胞相同,嗜酸性粒细胞一旦被活化,就会释放毒性颗粒等免疫刺激介质来抵抗致病微生物感染。嗜酸性粒细胞依靠炎症信号将其募集到损伤、感染或过敏反应的部位,从而将其活化并具有效应功能。除了能对寄生虫等感染反应之外,嗜酸性粒细胞还参与慢性炎症、呼吸道哮喘和食物过敏等疾病过程。
传统观念认为从嗜酸性粒细胞是一类异质性低、功能较单一、生命周期短、只在疾病状态下才会发挥促炎功能的终末分化细胞。因此,相对于淋巴细胞、巨噬细胞等其他免疫细胞而言,嗜酸性粒细胞一直是免疫学领域的“冷门”细胞,不是免疫学家关注和研究的重点和热点。然而,在健康人以及动物模型中,以小肠为代表的粘膜组织内含有大量的嗜酸性粒细胞。早年有报道发现人体小肠中的酸性粒细胞在稳态下会释放其内部的颗粒(DeBrosse et al., Pediatr Dev Pathol. 2006);而近期也有研究表明这些在组织稳态中存在的嗜酸性粒细胞可以参与调节了小肠肠绒毛的形态(Ignacio et al., Immunity, 2022)。这些现象暗示着嗜酸性粒细胞可能在小肠中存在着未被发现的作用。因此从2019年开始,徐和平课题组博士生李瑜就围绕小肠稳态下嗜酸性粒细胞的功能以及细胞活性调节信号开展了研究工作。
为了探究小肠嗜酸性粒细胞的分子特征,作者首先优化了实验流程和方法,克服了嗜酸性粒细胞内含有的RNA酶等其他对转录研究不兼容的胞内介质带来的困难,成功地对小鼠模型中小肠、骨髓、皮肤等7个主要组织中嗜酸性粒细胞的转录组进行了采集;通过数据分析揭示了一系列具有组织特异性的嗜酸性粒细胞分子特征。比如,对比其他组织中的嗜酸性粒细胞,发现了神经肽NMU 1类受体分子(neuromedin U receptor 1, NMUR1)仅在小肠嗜酸性粒细胞中特异性的表达。进一步通过全组织荧光共聚焦成像、以及透射电镜分析,发现小肠中嗜酸性粒细胞与肠道内的神经纤维存在着非常紧密的接触。这一特殊的基因表达模式以及组织定位关系,提示了嗜酸性粒细胞可能可以直接接收肠道内神经信号的调控并发挥特殊的功能。
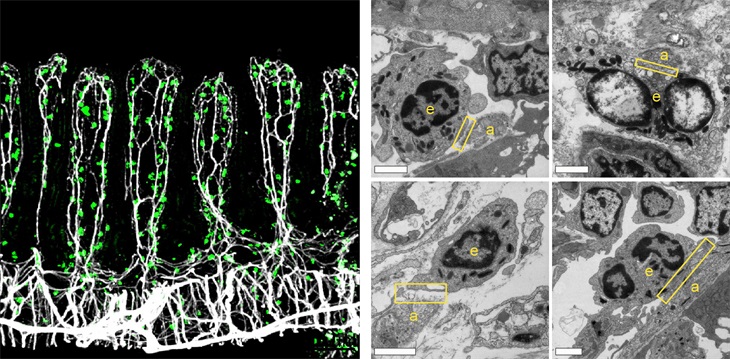
左图:肠道组织免疫荧光成像显示神经元纤维(白色)与嗜酸性粒细胞(绿色)互作;右图:透射电镜结果显示了多个嗜酸性粒细胞(e)与神经纤维(a)互作的界面(方框区域)。
NMU 是一种结构上高度保守的神经肽,广泛分布在下丘脑、垂体以及胃肠道系统中,具有刺激平滑肌收缩、抑制摄食、抑制胃酸分泌等多种功能。近些年NMU受体NMUR1在免疫系统中的研究取得了较多进展。比如,研究发现NMU-NMUR1可以直接促进2型先天样淋巴细胞(group 2 innate lymphoid cells, ILC2s)的活性 (Wallrapp, et al., Naure 2017; Klose et al., Nature2017; Cardoso et al., Nature 2017)。此外近期有课题组报道认为NMUR1是ILC2特征性表达的分子,不在ILC2之外的任何细胞中表达 (Tsou, et al., Naure 2022; Jarick et al., Nature 2022; Cardoso et al., Nature 2017)。显然这一结论与作者的转录分析结果并不一致。为了明确NMUR1在不同组织、细胞中的表达模式,作者构建了内源NMUR1表达报告小鼠模型(Nmur1iCre-TdT小鼠),并分析明确了在ILC2之外,小肠中嗜酸性粒细胞的确表达NMUR1。同时作者进一步分析发现NMUR1也在人的小肠嗜酸性粒细胞上特异性表达。
于是接下来作者利用Nmur1iCre-TdT小鼠对表达NMUR1的嗜酸性粒细胞的特性进行探究。主要发现NMUR1+嗜酸性粒细胞存在特殊的理化性质以及蛋白表达特征。比如其细胞核主要有双叶与椭圆两种形态,而小肠NMUR1-嗜酸性粒细胞主要为环形核; NMUR1+嗜酸性粒细胞表达更高的组织适应性特征分子以及脱颗粒特征分子。进一步结合透射电镜结果证实NMUR1+嗜酸性粒细胞在静息状态下的确有更强的脱颗粒活动。这些差异说明NMUR1+嗜酸性粒细胞具有更高的活化程度以及更高的组织适应性改变。
随后作者通过探究NMUR1+嗜酸性粒细胞的发育情况以及炎症状态下该细胞群的动态变化,揭示了NMUR1在嗜酸性粒细胞的表达由小肠特殊的微环境调控并在炎症情况下上调表达。为了探究这群特殊的NMUR1+嗜酸性粒细胞活动的功能,作者通过构建多种遗传学小鼠模型发现NMUR1参与维持小肠中嗜酸性粒细胞数量,并调控嗜酸性粒细胞脱颗粒活动。并且进一步通过组成成像分析发现嗜酸性粒细胞缺失NMUR1会减少小肠上皮杯状细胞的分化以及减弱抗寄生虫感染免疫力。
最后,作者采用体内化学遗传学方法操纵NMU+神经元活性、以及体外建立嗜酸性粒细胞-小肠上皮类器官共培养系统,揭示嗜酸性粒细胞直接调控小肠杯状细胞分化,且NMU-NMUR1信号通过调控嗜酸性粒细胞参与该过程。
总之,本研究揭示了NMU-NMUR1信号特异地驱动小肠嗜酸性粒细胞进行转录、蛋白和功能层面的适应性改变,并在稳态和炎症状态下调节小肠上皮细胞的分化。该研究为神经-免疫-上皮系统之间的交互提供给了新的见解,也为理解嗜酸性粒细胞的新功能以及相关临床疾病的研究开辟了新的思路。
西湖大学徐和平研究院为论文通讯作者,西湖大学-浙江大学联培项目博士研究生李瑜(2019级)为本文第一作者。大数据分析工作由刘少睿完成;西湖大学博士生周可文(2022级)在成像、测序等方面为项目推进做出了重要贡献;临床样本研究是与浙江大学医学院附属第二医院消化科陈焰主任团队合作完成。本项目受到科技部重点研发计划、国家自然基金委、西湖实验室HRHI项目、以及西湖教育基金会的资助;项目实施过程中得到了西湖大学实验动物中心、流式平台、基因组学平台以及超算平台的大力支持。
文章链接:https://www.science.org/doi/10.1126/science.ade4177
粒细胞是一种异质性白细胞,其包括中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞。粒细胞是天然免疫细胞,其特征是胞浆中存在分泌性细胞毒性颗粒,并且为多形核。粒细胞中数量最多的是中性粒细胞,其次是嗜酸性粒细胞。与其他粒细胞相同,嗜酸性粒细胞一旦被活化,就会释放毒性颗粒等免疫刺激介质来抵抗致病微生物感染。嗜酸性粒细胞依靠炎症信号将其募集到损伤、感染或过敏反应的部位,从而将其活化并具有效应功能。除了能对寄生虫等感染反应之外,嗜酸性粒细胞还参与慢性炎症、呼吸道哮喘和食物过敏等疾病过程。
传统观念认为从嗜酸性粒细胞是一类异质性低、功能较单一、生命周期短、只在疾病状态下才会发挥促炎功能的终末分化细胞。因此,相对于淋巴细胞、巨噬细胞等其他免疫细胞而言,嗜酸性粒细胞一直是免疫学领域的“冷门”细胞,不是免疫学家关注和研究的重点和热点。然而,在健康人以及动物模型中,以小肠为代表的粘膜组织内含有大量的嗜酸性粒细胞。早年有报道发现人体小肠中的酸性粒细胞在稳态下会释放其内部的颗粒(DeBrosse et al., Pediatr Dev Pathol. 2006);而近期也有研究表明这些在组织稳态中存在的嗜酸性粒细胞可以参与调节了小肠肠绒毛的形态(Ignacio et al., Immunity, 2022)。这些现象暗示着嗜酸性粒细胞可能在小肠中存在着未被发现的作用。因此从2019年开始,徐和平课题组博士生李瑜就围绕小肠稳态下嗜酸性粒细胞的功能以及细胞活性调节信号开展了研究工作。
为了探究小肠嗜酸性粒细胞的分子特征,作者首先优化了实验流程和方法,克服了嗜酸性粒细胞内含有的RNA酶等其他对转录研究不兼容的胞内介质带来的困难,成功地对小鼠模型中小肠、骨髓、皮肤等7个主要组织中嗜酸性粒细胞的转录组进行了采集;通过数据分析揭示了一系列具有组织特异性的嗜酸性粒细胞分子特征。比如,对比其他组织中的嗜酸性粒细胞,发现了神经肽NMU 1类受体分子(neuromedin U receptor 1, NMUR1)仅在小肠嗜酸性粒细胞中特异性的表达。进一步通过全组织荧光共聚焦成像、以及透射电镜分析,发现小肠中嗜酸性粒细胞与肠道内的神经纤维存在着非常紧密的接触。这一特殊的基因表达模式以及组织定位关系,提示了嗜酸性粒细胞可能可以直接接收肠道内神经信号的调控并发挥特殊的功能。

左图:肠道组织免疫荧光成像显示神经元纤维(白色)与嗜酸性粒细胞(绿色)互作;右图:透射电镜结果显示了多个嗜酸性粒细胞(e)与神经纤维(a)互作的界面(方框区域)。
NMU 是一种结构上高度保守的神经肽,广泛分布在下丘脑、垂体以及胃肠道系统中,具有刺激平滑肌收缩、抑制摄食、抑制胃酸分泌等多种功能。近些年NMU受体NMUR1在免疫系统中的研究取得了较多进展。比如,研究发现NMU-NMUR1可以直接促进2型先天样淋巴细胞(group 2 innate lymphoid cells, ILC2s)的活性 (Wallrapp, et al., Naure 2017; Klose et al., Nature2017; Cardoso et al., Nature 2017)。此外近期有课题组报道认为NMUR1是ILC2特征性表达的分子,不在ILC2之外的任何细胞中表达 (Tsou, et al., Naure 2022; Jarick et al., Nature 2022; Cardoso et al., Nature 2017)。显然这一结论与作者的转录分析结果并不一致。为了明确NMUR1在不同组织、细胞中的表达模式,作者构建了内源NMUR1表达报告小鼠模型(Nmur1iCre-TdT小鼠),并分析明确了在ILC2之外,小肠中嗜酸性粒细胞的确表达NMUR1。同时作者进一步分析发现NMUR1也在人的小肠嗜酸性粒细胞上特异性表达。
于是接下来作者利用Nmur1iCre-TdT小鼠对表达NMUR1的嗜酸性粒细胞的特性进行探究。主要发现NMUR1+嗜酸性粒细胞存在特殊的理化性质以及蛋白表达特征。比如其细胞核主要有双叶与椭圆两种形态,而小肠NMUR1-嗜酸性粒细胞主要为环形核; NMUR1+嗜酸性粒细胞表达更高的组织适应性特征分子以及脱颗粒特征分子。进一步结合透射电镜结果证实NMUR1+嗜酸性粒细胞在静息状态下的确有更强的脱颗粒活动。这些差异说明NMUR1+嗜酸性粒细胞具有更高的活化程度以及更高的组织适应性改变。
随后作者通过探究NMUR1+嗜酸性粒细胞的发育情况以及炎症状态下该细胞群的动态变化,揭示了NMUR1在嗜酸性粒细胞的表达由小肠特殊的微环境调控并在炎症情况下上调表达。为了探究这群特殊的NMUR1+嗜酸性粒细胞活动的功能,作者通过构建多种遗传学小鼠模型发现NMUR1参与维持小肠中嗜酸性粒细胞数量,并调控嗜酸性粒细胞脱颗粒活动。并且进一步通过组成成像分析发现嗜酸性粒细胞缺失NMUR1会减少小肠上皮杯状细胞的分化以及减弱抗寄生虫感染免疫力。
最后,作者采用体内化学遗传学方法操纵NMU+神经元活性、以及体外建立嗜酸性粒细胞-小肠上皮类器官共培养系统,揭示嗜酸性粒细胞直接调控小肠杯状细胞分化,且NMU-NMUR1信号通过调控嗜酸性粒细胞参与该过程。
总之,本研究揭示了NMU-NMUR1信号特异地驱动小肠嗜酸性粒细胞进行转录、蛋白和功能层面的适应性改变,并在稳态和炎症状态下调节小肠上皮细胞的分化。该研究为神经-免疫-上皮系统之间的交互提供给了新的见解,也为理解嗜酸性粒细胞的新功能以及相关临床疾病的研究开辟了新的思路。
西湖大学徐和平研究院为论文通讯作者,西湖大学-浙江大学联培项目博士研究生李瑜(2019级)为本文第一作者。大数据分析工作由刘少睿完成;西湖大学博士生周可文(2022级)在成像、测序等方面为项目推进做出了重要贡献;临床样本研究是与浙江大学医学院附属第二医院消化科陈焰主任团队合作完成。本项目受到科技部重点研发计划、国家自然基金委、西湖实验室HRHI项目、以及西湖教育基金会的资助;项目实施过程中得到了西湖大学实验动物中心、流式平台、基因组学平台以及超算平台的大力支持。
文章链接:https://www.science.org/doi/10.1126/science.ade4177
