学术动态
胡兴斌/刘琴团队《Cell》揭示补体介导的溶血中红细胞程序性死亡机制
作者:胡兴斌 来源自:中国免疫学会 点击数:7372 发布时间:2025-06-25
2025年5月29日,空军军医大学附属西京医院输血科胡兴斌副教授团队联合华东理工大学生物工程学院刘琴教授团队,在《Cell》杂志上发表了题为“Red blood cells undergo lytic programmed cell death involving NLRP3”的研究论文(https://doi.org/10.1016/j.cell.2025.03.039)。该论文证实红细胞在补体激活后,不仅受到补体攻膜复合物的打孔破坏,还因胞内NLRP3-ASC-Caspase-8-Spectrin-β信号活化而发生程序性死亡,研究者将这种红细胞的死亡方式定义为spectosis(血影蛋白依赖性死亡),补充完善了补体溶血理论,为溶血性疾病的预防、诊断和治疗开辟了新视野。该研究发表后,同期《Cell》杂志在Leading edge中刊发了题为“ExSPECKt the unexpected: NLRP3-caspase-8-dependent cell death in RBCs”的preview(https://doi.org/10.1016/j.cell.2025.04.033);其旗下刊物《Immunity》杂志也以“Spectosis: Dying for a complement”为题,刊发了Spotlight(>https://doi.org/10.1016/j.immuni.2025.05.017)。
人类成熟红细胞约占机体细胞总数的70-80%。1919年,Jules Bordet因发现补体而获得诺贝尔生理学或医学奖,1934年Karl Landsteiner因发现人类ABO血型而获得诺贝尔医学或生理学奖。经典溶血理论认为,人类红细胞血型的抗原抗体反应激活补体后,形成攻膜复合物在红细胞膜上打孔破坏细胞,造成血红蛋白泄漏,游离血红蛋白分解成血红素严重损伤肝、肾和神经系统,同时红细胞数量减少使得组织供氧不足威胁生命。阵发性睡眠性血红蛋白尿等溶血疾病也存在补体异常活化,因此以补体C3或C5为靶标的药物已用于各类补体活化的溶血性疾病,但近50%的患者疗效不佳,仍严重依赖输血治疗。最近以B因子为靶标的药物进入临床以后,疗效有所提升,但仍存在部分患者对药物响应不佳的现象,提示可能存在其他的未知溶血机制。基于上述临床问题,研究团队系统解析了补体活化后红细胞的胞内信号通路,以期探索更精准、更全面的干预策略,为突破现有治疗瓶颈提供理论依据。
研究团队通过分子生物学、 体外活细胞平台、质谱蛋白组学、基因编辑、骨髓移植、体外造血干细胞向红细胞定向诱导分化、结构生物学分析预测和流体力学多参数分析等多学科技术交叉,揭示补体介导的溶血不是简单的瞬间破膜崩解,而是通过连续性、可识别分辨的形态演变,最终才形成血影(ghost)而死亡;研究团队同步证实了此类红细胞死亡的过程受控于信号转导:红细胞的补体活化后,可通过胞内NLRP3-ASC复合物募集并活化Caspase-8,活化的Caspase-8切割胞膜中的Spectrin-β骨架蛋白,导致红细胞膜骨架网络崩塌,发生程序性死亡;单碱基基因编辑突变Spectrin-β相应氨基酸位点后,可逃逸活化Caspase-8的切割效应。基于该机制,研究团队采用抑制NLRP3或Caspase-8的策略可有效缓解溶血,而针对补体与NLRP3-Caspase-8双信号途径进行干预后,缓解溶血的效率可进一步提高。
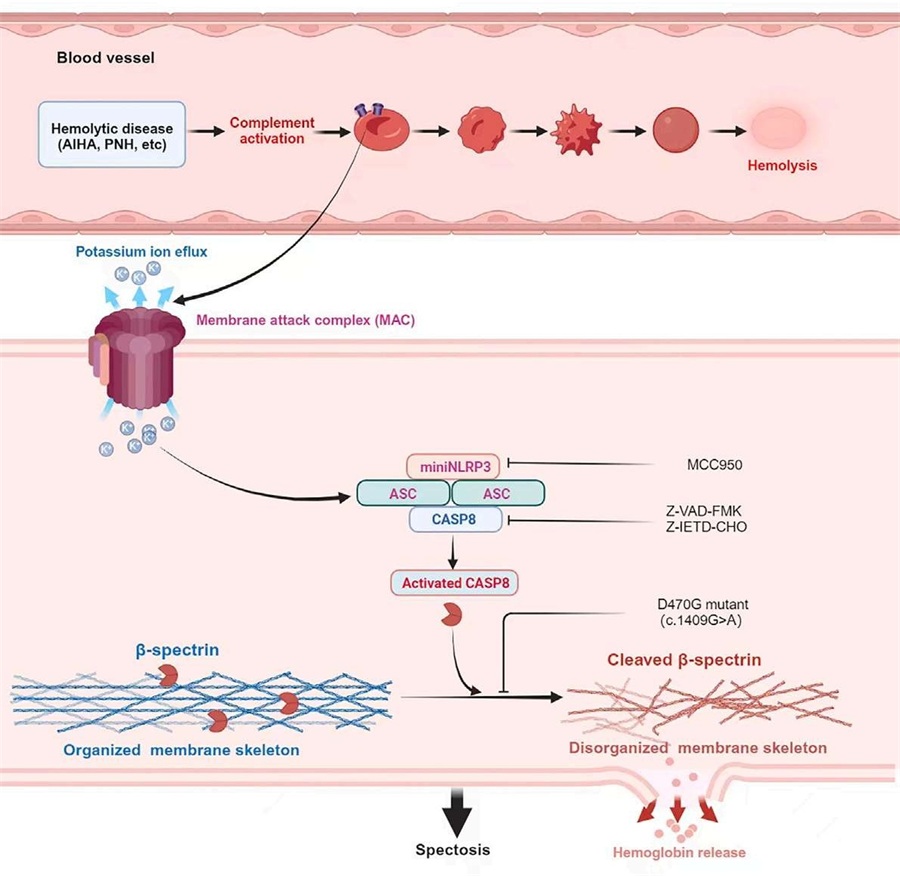
该原创性研究为补体介导的各类溶血性疾病诊治提供了全新策略,为自身免疫性溶血性贫血和阵发性睡眠性血红蛋白尿等患者带来了新希望。此外该发现拓展了红细胞研究的免疫视角——作为机体的关键细胞之一,其程序性死亡的信号转导与NLRP3、补体活化直接关联,为理解红细胞在系统性炎症免疫应答中的角色提供了新角度。人类成熟红细胞一般无细胞器、细胞核,在蛋白组成、功能调控、代谢等方面和有核细胞有很大差异,研究团队将NRLP3引入无核的成熟红细胞研究领域,开辟了炎症小体和炎症应答研究的新方向。NLRP3的活化源多种多样,有核细胞中LPS、ATP、MSU、钾离子外流和晶体等对NLRP3的活化作用已有广泛报道和使用,该研究证实ABO血型抗原抗体反应也可活化NRLP3,更表明NLRP3的活化存在尚未发现的共同途径。
空军军医大学西京医院输血科胡兴斌副教授为论文通讯作者,华东理工大学生物工程学院刘琴教授、陈守文副研究员为共同通讯作者;西京医院输血科陈要臻副研究员为第一作者,华东理工大学陈守文副研究员、西京医院刘志新副主任技师和王雅芬医师为共同第一作者,参与该项目的还有来自香港中文大学(深圳)Kobilka药物创新研究院的研究者。该研究得到了国家“十四五重点”研发计划、国家自然科学基金项目的资助。
人类成熟红细胞约占机体细胞总数的70-80%。1919年,Jules Bordet因发现补体而获得诺贝尔生理学或医学奖,1934年Karl Landsteiner因发现人类ABO血型而获得诺贝尔医学或生理学奖。经典溶血理论认为,人类红细胞血型的抗原抗体反应激活补体后,形成攻膜复合物在红细胞膜上打孔破坏细胞,造成血红蛋白泄漏,游离血红蛋白分解成血红素严重损伤肝、肾和神经系统,同时红细胞数量减少使得组织供氧不足威胁生命。阵发性睡眠性血红蛋白尿等溶血疾病也存在补体异常活化,因此以补体C3或C5为靶标的药物已用于各类补体活化的溶血性疾病,但近50%的患者疗效不佳,仍严重依赖输血治疗。最近以B因子为靶标的药物进入临床以后,疗效有所提升,但仍存在部分患者对药物响应不佳的现象,提示可能存在其他的未知溶血机制。基于上述临床问题,研究团队系统解析了补体活化后红细胞的胞内信号通路,以期探索更精准、更全面的干预策略,为突破现有治疗瓶颈提供理论依据。
研究团队通过分子生物学、 体外活细胞平台、质谱蛋白组学、基因编辑、骨髓移植、体外造血干细胞向红细胞定向诱导分化、结构生物学分析预测和流体力学多参数分析等多学科技术交叉,揭示补体介导的溶血不是简单的瞬间破膜崩解,而是通过连续性、可识别分辨的形态演变,最终才形成血影(ghost)而死亡;研究团队同步证实了此类红细胞死亡的过程受控于信号转导:红细胞的补体活化后,可通过胞内NLRP3-ASC复合物募集并活化Caspase-8,活化的Caspase-8切割胞膜中的Spectrin-β骨架蛋白,导致红细胞膜骨架网络崩塌,发生程序性死亡;单碱基基因编辑突变Spectrin-β相应氨基酸位点后,可逃逸活化Caspase-8的切割效应。基于该机制,研究团队采用抑制NLRP3或Caspase-8的策略可有效缓解溶血,而针对补体与NLRP3-Caspase-8双信号途径进行干预后,缓解溶血的效率可进一步提高。

该原创性研究为补体介导的各类溶血性疾病诊治提供了全新策略,为自身免疫性溶血性贫血和阵发性睡眠性血红蛋白尿等患者带来了新希望。此外该发现拓展了红细胞研究的免疫视角——作为机体的关键细胞之一,其程序性死亡的信号转导与NLRP3、补体活化直接关联,为理解红细胞在系统性炎症免疫应答中的角色提供了新角度。人类成熟红细胞一般无细胞器、细胞核,在蛋白组成、功能调控、代谢等方面和有核细胞有很大差异,研究团队将NRLP3引入无核的成熟红细胞研究领域,开辟了炎症小体和炎症应答研究的新方向。NLRP3的活化源多种多样,有核细胞中LPS、ATP、MSU、钾离子外流和晶体等对NLRP3的活化作用已有广泛报道和使用,该研究证实ABO血型抗原抗体反应也可活化NRLP3,更表明NLRP3的活化存在尚未发现的共同途径。
空军军医大学西京医院输血科胡兴斌副教授为论文通讯作者,华东理工大学生物工程学院刘琴教授、陈守文副研究员为共同通讯作者;西京医院输血科陈要臻副研究员为第一作者,华东理工大学陈守文副研究员、西京医院刘志新副主任技师和王雅芬医师为共同第一作者,参与该项目的还有来自香港中文大学(深圳)Kobilka药物创新研究院的研究者。该研究得到了国家“十四五重点”研发计划、国家自然科学基金项目的资助。
