学术动态
邝栋明团队《Cell》揭示葡萄糖限制诱导肺部促转移免疫环境新机制
作者:邝栋明 来源自:中国免疫学会 点击数:6027 发布时间:2025-07-18
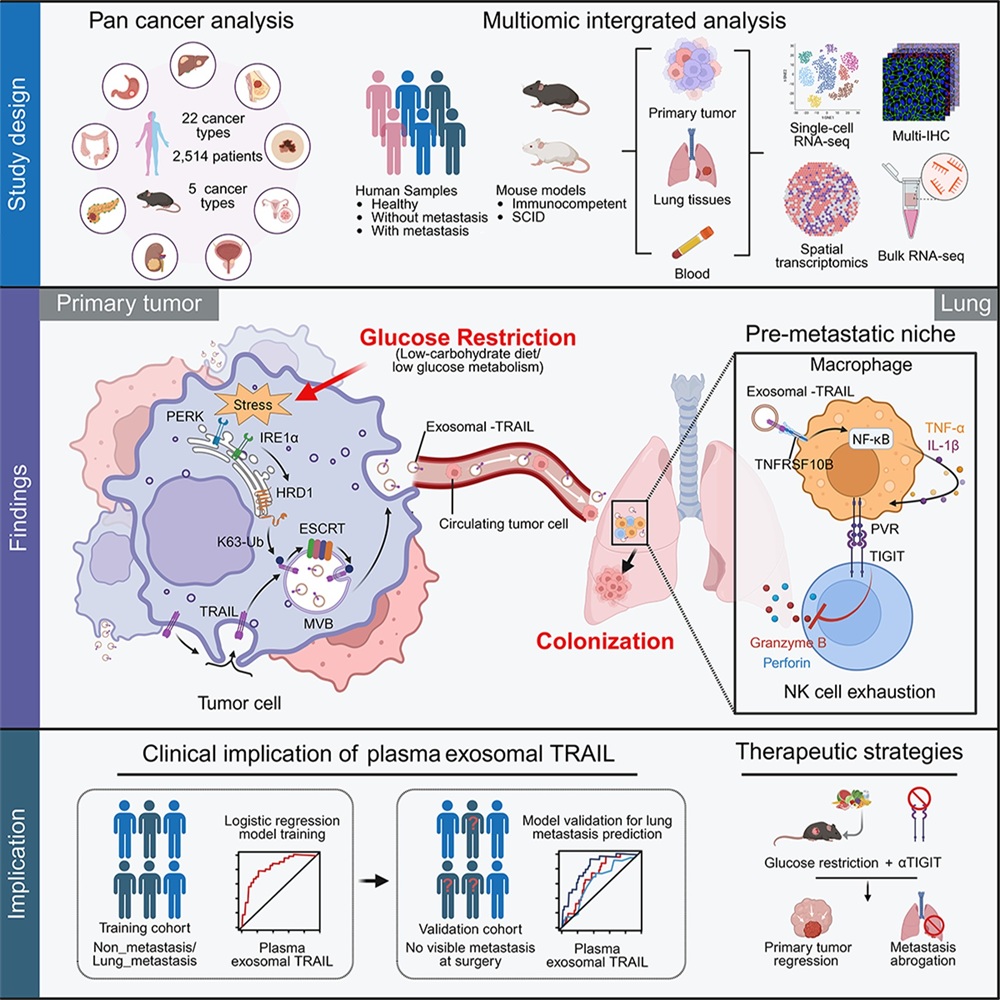
2025年7月15日,中山大学生命科学学院邝栋明教授、魏瑗副教授团队在《Cell》上发表了题为“Glucose Restriction Shapes Pre-Metastatic Innate Immune Landscapes in Lung through Exosomal TRAIL”的研究论文。该研究聚焦肿瘤糖代谢干预与免疫微环境间的复杂互作网络,首次揭示低碳水化合物饮食或肿瘤葡萄糖代谢缺陷通过重塑肺部先天免疫环境促进肿瘤转移的机制,并提出血浆外泌体TRAIL可作为一种有效的生物标志物,精准识别具有肺转移风险的肝癌患者。
葡萄糖代谢是支撑肿瘤快速增殖的核心能量来源。因此,葡萄糖剥夺(如低碳水化合物饮食)被视为一种有前景的抗肿瘤策略。然而,临床上导致肿瘤患者高死亡率的根本原因,并非源于原发灶的无限生长,而是肿瘤的远处转移。一个关键但尚未解决的问题是:限制葡萄糖代谢是否可能在抑制肿瘤生长的同时,诱导其向更具转移性的表型演化?值得注意的是,靶向葡萄糖代谢不仅仅是削弱肿瘤细胞的能量供给,还会激活多种应激反应,进而改变胞内及胞外微环境的组成与功能。以往研究多聚焦于葡萄糖代谢对肿瘤本身生长的调控,却忽视了其对整体微环境的影响。事实上,肿瘤细胞对葡萄糖的激烈竞争可能造成肿瘤局部区域的葡萄糖缺乏,而这些“葡萄糖饥饿”的肿瘤细胞是否会通过“旁观者效应”影响邻近的葡萄糖代谢正常的肿瘤细胞,仍有待深入探索。
研究团队通过15种肿瘤类型的大规模临床数据分析发现,葡萄糖代谢活性低的患者,其术后两年内出现复发的风险显著升高。进一步分析显示,术后两年内发生肺转移的肝癌患者,其肿瘤组织葡萄糖代谢活性明显更低。利用多种小鼠肿瘤模型,研究者证实低碳水化合物饮食或葡萄糖代谢缺陷均可在不依赖原发瘤生长的情况下显著促进肺转移。值得注意的是,这一过程并非由于葡萄糖缺乏肿瘤细胞自身转移能力的增强,而是通过“旁观者效应”促进了邻近葡萄糖代谢正常的肿瘤细胞扩散。这些研究结果表明,葡萄糖代谢缺陷的肿瘤细胞可塑造一种显著促进正常肿瘤细胞肺转移的微环境。
机制研究显示,葡萄糖剥夺诱导肿瘤细胞发生内质网应激,进而激活HRD1催化TRAIL的K63位点泛素化修饰,并通过ESCRT复合体将其包装入外泌体。释放的外泌体TRAIL可诱导肺部PVR⁺巨噬细胞极化,随后通过PVR–TIGIT轴耗竭NK细胞功能,从而建立有利于肿瘤扩散的转移前微环境。基于此,研究者提出联合靶向肿瘤细胞糖代谢和阻断TIGIT的治疗策略,不仅可以显著抑制原位肿瘤的进展,还可阻断代谢剥夺诱导的远端转移风险。此外,血浆外泌体TRAIL可作为一种有效的生物标志物,其预测肝癌术后早期肺转移的能力优于传统标志物(如AFP和肿瘤体积)。
该研究是邝栋明团队继在《Cancer Cell》(2024)揭示抗原交叉呈递驱动免疫治疗进展机制、以及在《Immunity》(2025)报道肝癌中多胺代谢重编程驱动免疫抑制的新机制后的又一重要成果,系统阐明了肿瘤糖代谢干预与免疫微环境间的复杂互作机制。
中山大学生命科学学院邝栋明教授和魏瑗副教授为该论文的通讯作者。中山大学生命科学学院吴财源博士、黄春祥博士、中山大学肿瘤防治中心劳向明主任医师为该论文的共同第一作者。海军军医大学东方肝胆外科医院陈磊教授、中国科学技术大学刘连新教授和中山大学生命科学学院郑利民教授亦为该研究给予了重要支持。
原文链接:https://doi.org/10.1016/j.cell.2025.06.027
葡萄糖代谢是支撑肿瘤快速增殖的核心能量来源。因此,葡萄糖剥夺(如低碳水化合物饮食)被视为一种有前景的抗肿瘤策略。然而,临床上导致肿瘤患者高死亡率的根本原因,并非源于原发灶的无限生长,而是肿瘤的远处转移。一个关键但尚未解决的问题是:限制葡萄糖代谢是否可能在抑制肿瘤生长的同时,诱导其向更具转移性的表型演化?值得注意的是,靶向葡萄糖代谢不仅仅是削弱肿瘤细胞的能量供给,还会激活多种应激反应,进而改变胞内及胞外微环境的组成与功能。以往研究多聚焦于葡萄糖代谢对肿瘤本身生长的调控,却忽视了其对整体微环境的影响。事实上,肿瘤细胞对葡萄糖的激烈竞争可能造成肿瘤局部区域的葡萄糖缺乏,而这些“葡萄糖饥饿”的肿瘤细胞是否会通过“旁观者效应”影响邻近的葡萄糖代谢正常的肿瘤细胞,仍有待深入探索。
研究团队通过15种肿瘤类型的大规模临床数据分析发现,葡萄糖代谢活性低的患者,其术后两年内出现复发的风险显著升高。进一步分析显示,术后两年内发生肺转移的肝癌患者,其肿瘤组织葡萄糖代谢活性明显更低。利用多种小鼠肿瘤模型,研究者证实低碳水化合物饮食或葡萄糖代谢缺陷均可在不依赖原发瘤生长的情况下显著促进肺转移。值得注意的是,这一过程并非由于葡萄糖缺乏肿瘤细胞自身转移能力的增强,而是通过“旁观者效应”促进了邻近葡萄糖代谢正常的肿瘤细胞扩散。这些研究结果表明,葡萄糖代谢缺陷的肿瘤细胞可塑造一种显著促进正常肿瘤细胞肺转移的微环境。
机制研究显示,葡萄糖剥夺诱导肿瘤细胞发生内质网应激,进而激活HRD1催化TRAIL的K63位点泛素化修饰,并通过ESCRT复合体将其包装入外泌体。释放的外泌体TRAIL可诱导肺部PVR⁺巨噬细胞极化,随后通过PVR–TIGIT轴耗竭NK细胞功能,从而建立有利于肿瘤扩散的转移前微环境。基于此,研究者提出联合靶向肿瘤细胞糖代谢和阻断TIGIT的治疗策略,不仅可以显著抑制原位肿瘤的进展,还可阻断代谢剥夺诱导的远端转移风险。此外,血浆外泌体TRAIL可作为一种有效的生物标志物,其预测肝癌术后早期肺转移的能力优于传统标志物(如AFP和肿瘤体积)。

该研究是邝栋明团队继在《Cancer Cell》(2024)揭示抗原交叉呈递驱动免疫治疗进展机制、以及在《Immunity》(2025)报道肝癌中多胺代谢重编程驱动免疫抑制的新机制后的又一重要成果,系统阐明了肿瘤糖代谢干预与免疫微环境间的复杂互作机制。
中山大学生命科学学院邝栋明教授和魏瑗副教授为该论文的通讯作者。中山大学生命科学学院吴财源博士、黄春祥博士、中山大学肿瘤防治中心劳向明主任医师为该论文的共同第一作者。海军军医大学东方肝胆外科医院陈磊教授、中国科学技术大学刘连新教授和中山大学生命科学学院郑利民教授亦为该研究给予了重要支持。
原文链接:https://doi.org/10.1016/j.cell.2025.06.027
