学术动态
张永辉/肖俊宇团队破解γδ T细胞免疫识别新机制,为癌症免疫治疗提供新策略
作者:张永辉 来源自:中国免疫学会 点击数:5383 发布时间:2025-08-29
2025年7月8日,清华大学张永辉团队携手北京大学肖俊宇、苏州大学附属第一医院张学光等,在《Immunity》发表题为“Structures of butyrophilin multimers reveal a plier-like mechanism for Vγ9Vδ2 T cell receptor activation”的研究论文,完整揭示了这类γδ T细胞的免疫识别机制:在靶细胞内部,BTN3A1与BTN2A1协同结合磷抗原,实现对胞内代谢变化的高效感知;在靶细胞表面,BTN3A2与BTN3A1形成异源二聚体,并与BTN2A1共同构建出“分子钳”结构——一侧钳住TCR的Vγ9链,另一侧结合Vδ2链的顶端区域,驱动TCR发生构象变化,最终实现高效激活。
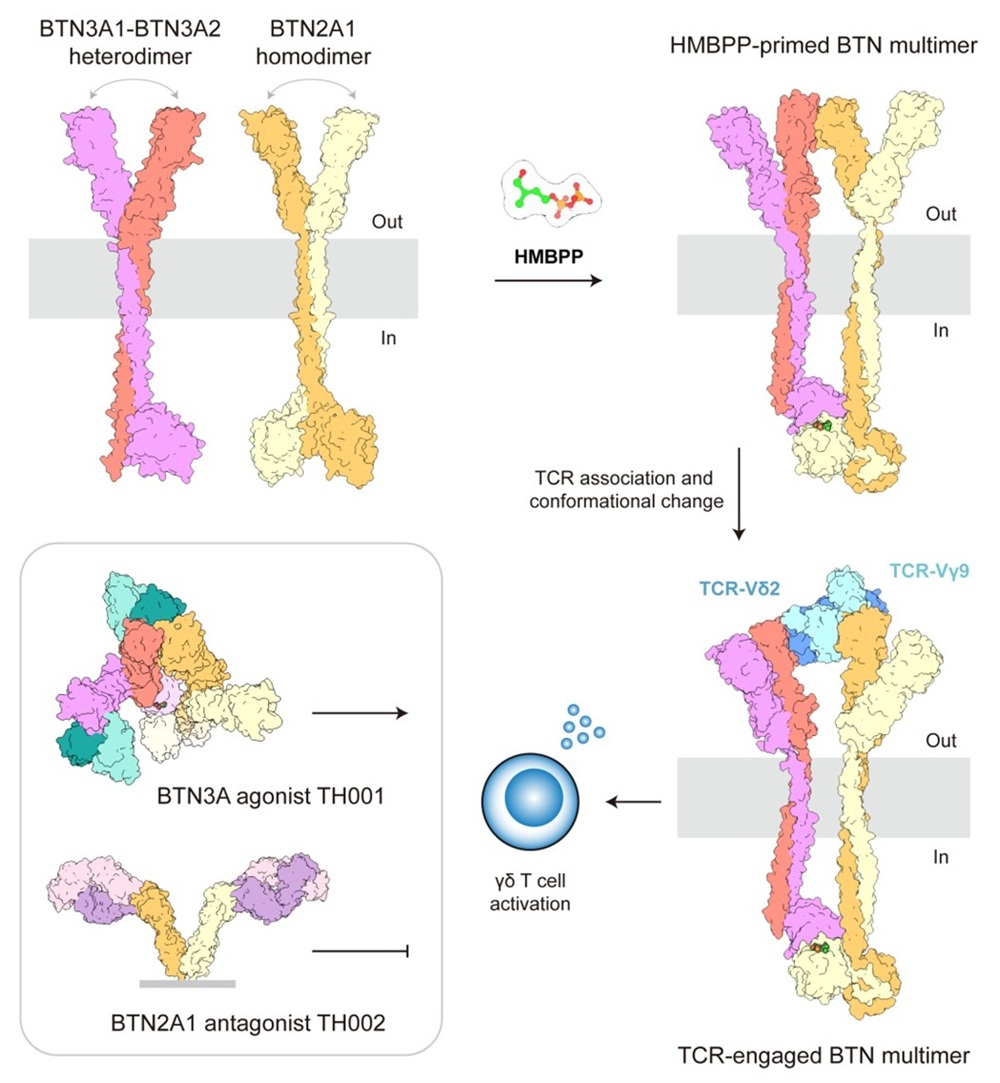
图:γδ T细胞依靠BTN3A1-BTN3A2-BTN2A1实现对胞内磷抗原高效感知
T细胞是免疫系统的核心组成部分,分为αβ T与γδ T两大亚群。其中,αβ T细胞通过识别MHC分子提呈的多肽抗原来激活免疫应答,这一机制已成为现代免疫学的基石。1984年发现的γδ T细胞,因其对肿瘤和病原体的快速响应能力,被认为是连接固有免疫与适应性免疫的“桥梁”。人体中最丰富的γδ T细胞亚群——Vγ9Vδ2 T细胞,它们通过感知靶细胞表面BTN3A1和BTN2A1蛋白传递的胞内代谢产物“磷抗原”信号,实现对异常细胞的快速识别。然而,其识别机制长期以来并不明确,尤其是butyrophilin家族蛋白(如BTN3A1、BTN3A2、BTN2A1)如何协同感知磷抗原并激活TCR,一直是领域内的核心难题。
研究团队成功纯化并解析了BTN3A1-BTN3A2-BTN2A1多聚体在结合磷抗原(HMBPP)及与TCR复合状态下的冷冻电镜结构。结构显示:BTN2A1从侧面结合TCR的Vγ9链,BTN3A2从顶端结合Vδ2链。此外,团队开发了BTN3A1激动抗体TH001和BTN2A1拮抗抗体TH002,并解析了它们发挥功能的结构机理:TH001可稳定BTN3A构象,促进TCR结合,体外实验显示其激活γδ T细胞杀伤肿瘤的效率比临床候选抗体ICT01高3倍;TH002可阻断BTN2A1与TCR结合,可抑制过度激活。
这一“钳状夹持”机制首次在结构层面统一了γδ T细胞的双重免疫特性:既通过胚系编码区域(germline-encoded)介导快速的固有免疫响应,又通过互补决定区(CDR3)介导特异性的适应性免疫识别。
这些持续多年的研究成果为γδ T细胞赋予了“通用性”和“即用型”双重优势:其TCR识别机制完全绕过MHC限制,并能靶向广泛表达于多种肿瘤细胞表面的BTN蛋白,不仅突破了肿瘤异质性难题,还使得γδ T细胞具备跨个体、跨癌种的广谱应用潜力,可被开发为可标准化量产的“现货型”细胞疗法。
张永辉和肖俊宇为论文的通讯作者,北京大学张迈和王一晴、苏州大学第一附属医院蔡宁宁、清华大学屈莹莹是论文的第一作者。
原文链接:https://doi.org/10.1016/j.immuni.2025.05.011

图:γδ T细胞依靠BTN3A1-BTN3A2-BTN2A1实现对胞内磷抗原高效感知
T细胞是免疫系统的核心组成部分,分为αβ T与γδ T两大亚群。其中,αβ T细胞通过识别MHC分子提呈的多肽抗原来激活免疫应答,这一机制已成为现代免疫学的基石。1984年发现的γδ T细胞,因其对肿瘤和病原体的快速响应能力,被认为是连接固有免疫与适应性免疫的“桥梁”。人体中最丰富的γδ T细胞亚群——Vγ9Vδ2 T细胞,它们通过感知靶细胞表面BTN3A1和BTN2A1蛋白传递的胞内代谢产物“磷抗原”信号,实现对异常细胞的快速识别。然而,其识别机制长期以来并不明确,尤其是butyrophilin家族蛋白(如BTN3A1、BTN3A2、BTN2A1)如何协同感知磷抗原并激活TCR,一直是领域内的核心难题。
研究团队成功纯化并解析了BTN3A1-BTN3A2-BTN2A1多聚体在结合磷抗原(HMBPP)及与TCR复合状态下的冷冻电镜结构。结构显示:BTN2A1从侧面结合TCR的Vγ9链,BTN3A2从顶端结合Vδ2链。此外,团队开发了BTN3A1激动抗体TH001和BTN2A1拮抗抗体TH002,并解析了它们发挥功能的结构机理:TH001可稳定BTN3A构象,促进TCR结合,体外实验显示其激活γδ T细胞杀伤肿瘤的效率比临床候选抗体ICT01高3倍;TH002可阻断BTN2A1与TCR结合,可抑制过度激活。
这一“钳状夹持”机制首次在结构层面统一了γδ T细胞的双重免疫特性:既通过胚系编码区域(germline-encoded)介导快速的固有免疫响应,又通过互补决定区(CDR3)介导特异性的适应性免疫识别。
这些持续多年的研究成果为γδ T细胞赋予了“通用性”和“即用型”双重优势:其TCR识别机制完全绕过MHC限制,并能靶向广泛表达于多种肿瘤细胞表面的BTN蛋白,不仅突破了肿瘤异质性难题,还使得γδ T细胞具备跨个体、跨癌种的广谱应用潜力,可被开发为可标准化量产的“现货型”细胞疗法。
张永辉和肖俊宇为论文的通讯作者,北京大学张迈和王一晴、苏州大学第一附属医院蔡宁宁、清华大学屈莹莹是论文的第一作者。
原文链接:https://doi.org/10.1016/j.immuni.2025.05.011
