学术动态
王硕团队《Nat Immunol》揭示表观遗传印记驱动黏膜固有淋巴细胞谱系分化
作者:王硕 来源自:中国免疫学会 点击数:3337 发布时间:2025-10-16
免疫系统的建立源于免疫细胞的逐级发育与分化,此过程受多种内外因素的精密调控。近年来研究发现造血干细胞等免疫干祖细胞存在异质性,免疫干祖细胞表现出向某一类免疫效应细胞分化的偏向性,这种偏向性的调控因素尚不清晰,免疫前体细胞产生不同类型效应细胞的调控过程有待进一步研究。
固有淋巴细胞(ILCs)是在黏膜组织中富集的固有淋巴细胞亚群,它们与T辅助细胞(Th)在功能上有许多相似之处。尽管功能相似,但它们的发育和分化途径却有很大差异。ILC前体细胞(ILCPs)在骨髓中发育,而T细胞前体在胸腺中发育。在外周,树突状细胞(DCs)呈递抗原并产生细胞因子,以促进具有不同功能的Th亚群的分化。ILCs的成熟和分化不需要抗原呈递,在相似的黏膜微环境中能够产生不同类型的ILC亚群。因此不同功能亚群ILCs的分化和命运决定可能具有其独特的调控机制,这也是该领域的重要科学问题。
中国科学院微生物研究所王硕课题组主要研究黏膜免疫系统的建立与稳态调控,揭示了肠道菌群调控黏膜免疫稳态与表观遗传修饰的功能机制。在此基础上,王硕团队进一步研究了黏膜固有淋巴细胞建立过程中的表观遗传印记。2025年9月18日,王硕团队在《Nature Immunology》期刊发表了题为“Epigenetic imprinting in innate lymphoid cell precursors directs the lineage segregation of innate lymphoid cells”的研究论文。该研究系统揭示了固有淋巴细胞前体细胞(ILCPs)的表观遗传印记在决定细胞谱系分化中的重要作用,建立了DNA甲基化示踪模型,为进一步理解黏膜免疫系统建立与免疫细胞发育过程中的表观遗传调控提供了新见解。
为了研究ILCPs的异质性以及ILCPs向ILC各亚类细胞分化过程中的转录组和表观遗传修饰的改变,研究团队绘制了ILCPs与ILC各亚群的单细胞水平的DNA甲基化、染色质可及性和转录组图谱,发现ILCPs可分为两个亚群(ILCP1和ILCP2)。ILCP2s的DNA甲基化水平较ILCP1s更低,并且呈现高度异质的DNA甲基化特征。研究团队通过进一步的降维聚类研究发现,ILCP2s可依据其DNA甲基化特性分为三类(ILCP2-ILC1、ILCP2-ILC2和ILCP2-ILC3),这些ILCP2亚群的DNA甲基化特征与其分化的效应ILC亚群相对应。
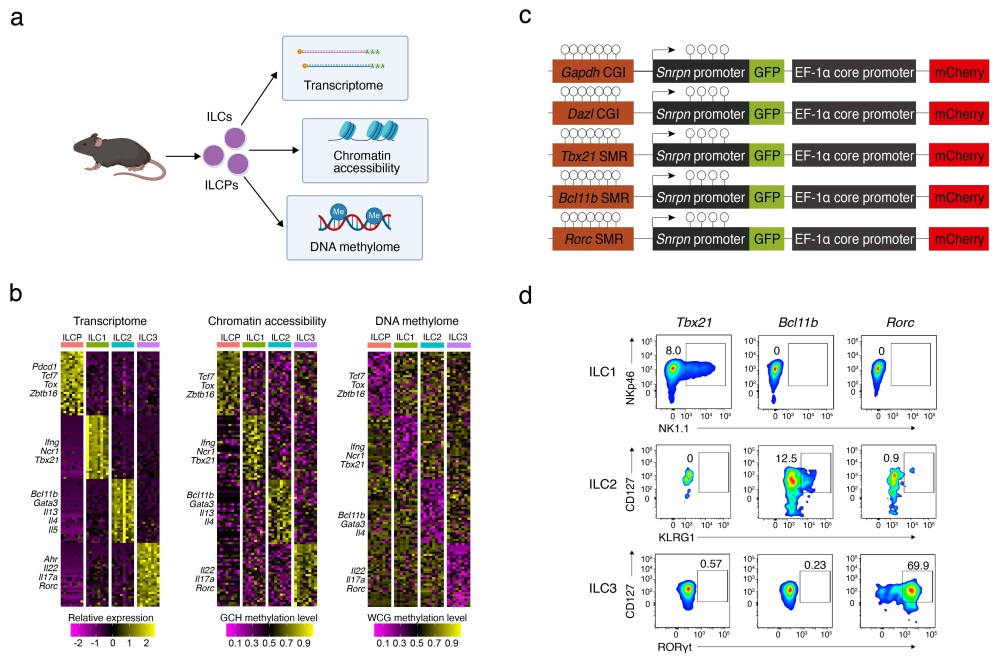
研究团队进一步定义并鉴定了各ILCP2亚群的特征性甲基化区域(signature methylation regions, SMRs),并建立了针对SMRs的免疫细胞谱系示踪技术,在ILCPs分化过程中对SMRs的DNA甲基化印记进行了谱系示踪。研究发现,携带与特定ILC亚群相对应低甲基化SMRs的ILCP2s能够特异的分化为相应的ILC亚群。对SMRs进行DNA甲基化编辑能够抑制ILCs的谱系分化,且在ILCPs中敲除DNA甲基化酶Dnmt1会破坏SMRs的异质性分布并导致ILC分化缺陷。上述结果表明,ILCPs存在DNA甲基化的异质性和谱系特征,在ILCPs发育分化过程中,DNA甲基化的表观遗传印记驱动了ILC谱系的定向分化方向。该研究揭示了黏膜固有淋巴细胞功能建立过程中表观遗传印记的决定性作用,为免疫细胞的命运决定调控提供新的理论依据。
中国科学院微生物研究所王硕课题组博士生刘臻、特别研究助理邵菲、厦门大学博士后张强为本文第一作者,中国科学院微生物研究所王硕研究员为本文的通讯作者。本研究得到了中国农业大学高帅教授、北京大学夏朋延研究员和中国科学院生物物理研究所张珠强研究员的支持与帮助。本项研究得到了国家重点研发计划、北京市自然科学基金和中国科学院基础前沿科学研究计划从0到1原始创新项目等基金的支持。
原文链接:https://www.nature.com/articles/s41590-025-02261-0
固有淋巴细胞(ILCs)是在黏膜组织中富集的固有淋巴细胞亚群,它们与T辅助细胞(Th)在功能上有许多相似之处。尽管功能相似,但它们的发育和分化途径却有很大差异。ILC前体细胞(ILCPs)在骨髓中发育,而T细胞前体在胸腺中发育。在外周,树突状细胞(DCs)呈递抗原并产生细胞因子,以促进具有不同功能的Th亚群的分化。ILCs的成熟和分化不需要抗原呈递,在相似的黏膜微环境中能够产生不同类型的ILC亚群。因此不同功能亚群ILCs的分化和命运决定可能具有其独特的调控机制,这也是该领域的重要科学问题。
中国科学院微生物研究所王硕课题组主要研究黏膜免疫系统的建立与稳态调控,揭示了肠道菌群调控黏膜免疫稳态与表观遗传修饰的功能机制。在此基础上,王硕团队进一步研究了黏膜固有淋巴细胞建立过程中的表观遗传印记。2025年9月18日,王硕团队在《Nature Immunology》期刊发表了题为“Epigenetic imprinting in innate lymphoid cell precursors directs the lineage segregation of innate lymphoid cells”的研究论文。该研究系统揭示了固有淋巴细胞前体细胞(ILCPs)的表观遗传印记在决定细胞谱系分化中的重要作用,建立了DNA甲基化示踪模型,为进一步理解黏膜免疫系统建立与免疫细胞发育过程中的表观遗传调控提供了新见解。
为了研究ILCPs的异质性以及ILCPs向ILC各亚类细胞分化过程中的转录组和表观遗传修饰的改变,研究团队绘制了ILCPs与ILC各亚群的单细胞水平的DNA甲基化、染色质可及性和转录组图谱,发现ILCPs可分为两个亚群(ILCP1和ILCP2)。ILCP2s的DNA甲基化水平较ILCP1s更低,并且呈现高度异质的DNA甲基化特征。研究团队通过进一步的降维聚类研究发现,ILCP2s可依据其DNA甲基化特性分为三类(ILCP2-ILC1、ILCP2-ILC2和ILCP2-ILC3),这些ILCP2亚群的DNA甲基化特征与其分化的效应ILC亚群相对应。

研究团队进一步定义并鉴定了各ILCP2亚群的特征性甲基化区域(signature methylation regions, SMRs),并建立了针对SMRs的免疫细胞谱系示踪技术,在ILCPs分化过程中对SMRs的DNA甲基化印记进行了谱系示踪。研究发现,携带与特定ILC亚群相对应低甲基化SMRs的ILCP2s能够特异的分化为相应的ILC亚群。对SMRs进行DNA甲基化编辑能够抑制ILCs的谱系分化,且在ILCPs中敲除DNA甲基化酶Dnmt1会破坏SMRs的异质性分布并导致ILC分化缺陷。上述结果表明,ILCPs存在DNA甲基化的异质性和谱系特征,在ILCPs发育分化过程中,DNA甲基化的表观遗传印记驱动了ILC谱系的定向分化方向。该研究揭示了黏膜固有淋巴细胞功能建立过程中表观遗传印记的决定性作用,为免疫细胞的命运决定调控提供新的理论依据。
中国科学院微生物研究所王硕课题组博士生刘臻、特别研究助理邵菲、厦门大学博士后张强为本文第一作者,中国科学院微生物研究所王硕研究员为本文的通讯作者。本研究得到了中国农业大学高帅教授、北京大学夏朋延研究员和中国科学院生物物理研究所张珠强研究员的支持与帮助。本项研究得到了国家重点研发计划、北京市自然科学基金和中国科学院基础前沿科学研究计划从0到1原始创新项目等基金的支持。
原文链接:https://www.nature.com/articles/s41590-025-02261-0
