学术动态
张连军/李贵登团队《Immunity》揭示琥珀酸增强CD8 T细胞长效抗肿瘤免疫反应的新机制
作者:张连军 来源自:中国免疫学会 点击数:5324 发布时间:2025-10-17
2025年10月14日,中国医学科学院系统医学研究院/苏州系统医学研究所张连军团队联合李贵登团队、顾志敏团队与瑞士洛桑大学路德维格癌症研究中心Ping-Chih Ho团队,在国际免疫学期刊《Immunity》发表题为“Succinate preserves CD8+ T cell fitness to augment antitumor immunity”的研究论文。该研究发现三羧酸循环代谢中间物琥珀酸,可通过激活线粒体自噬与表观遗传重塑,显著增强CD8+ T细胞存活、干性维持及持久抗肿瘤能力,为提升免疫治疗疗效提供了全新的代谢干预靶点。
肿瘤抗原特异性CD8⁺ T细胞是抗肿瘤免疫的核心执行者,然而在肿瘤微环境中其功能常因终末耗竭而受限。研究表明,T细胞的耗竭分化具有异质性,其中肿瘤引流淋巴结及肿瘤微环境中具有“干性样”特征的耗竭前体 T 细胞(Tpex)是维持长期免疫记忆及响应免疫检查点治疗的关键群体。然而,如何维持T细胞干性仍是肿瘤免疫领域内尚未解决的重要科学问题。T细胞的活化、分化与功能状态受到免疫信号与代谢信号的双重精密调控。琥珀酸作为三羧酸循环中的关键中间代谢物,在琥珀酸脱氢酶(SDH)突变型肿瘤中异常累积,但其在CD8⁺ T细胞介导的抗肿瘤免疫中的作用尚存争议,尤其是对于 T 细胞分化状态是否有直接调控作用还不清楚。因此,深入阐明琥珀酸对CD8⁺ T细胞功能分化的调控及机制,不仅有助于澄清现有争议,更对理解代谢微环境塑造T细胞免疫应答的理论框架及开发靶向代谢的免疫干预策略具有关键意义。
团队首先利用琥珀酸脱氢酶B亚基(SDHB)缺陷肿瘤模拟内源性琥珀酸富集肿瘤微环境,发现SDHB敲除可显著抑制肿瘤生长,并伴随肿瘤抗原特异性CD8⁺ T细胞数量上升,联合aPD-L1治疗可进一步增强该抗肿瘤免疫反应,而清除CD8⁺ T细胞则完全消除该效应,提示琥珀酸通过增强CD8⁺ T细胞功能发挥抗肿瘤作用。分析过继T细胞显示琥珀酸富集在促进T细胞增殖的同时抑制其凋亡。结合体外转录组测序分析,本研究证实琥珀酸的长期暴露促进T细胞“干性样”分化。机制研究揭示琥珀酸通过双重通路重塑T细胞功能:一方面,其通过增强OXPHOS活性与线粒体备用呼吸能力,并上调BNIP3介导的线粒体自噬以抑制mtROS积累与细胞凋亡;另一方面,通过调控组蛋白修饰(上调H3K4me3)促进干性相关基因(如Tcf7)的染色质开放与转录激活,进而诱导TCF-1等高表达和“干性样”CD8⁺ T细胞分化。进一步的功能验证表明,琥珀酸预处理的CD8⁺ T细胞在体内展现出显著增强的干性维持能力。在急性感染模型中,其分化轨迹明显偏向记忆表型,形成更多记忆前体效应细胞(MPECs)和中心记忆T细胞(TCM),并持续表达较高水平的TCF-1;在肿瘤过继治疗模型中,该潜能赋予T细胞更强的肿瘤控制能力,显著延长小鼠生存期并有效延缓终末耗竭进程。同样,经琥珀酸预处理的小鼠及人源CAR-T细胞在过继转移后均表现出更优的体内持久性与肿瘤清除效果。此外,转化研究显示基于公共转录组构建的肿瘤琥珀酸富集特征在一些黑色素瘤与胃癌队列中与免疫检查点抑制剂疗效及预后显著正相关,提示其作为一种新型预测性生物标志物的潜在价值。
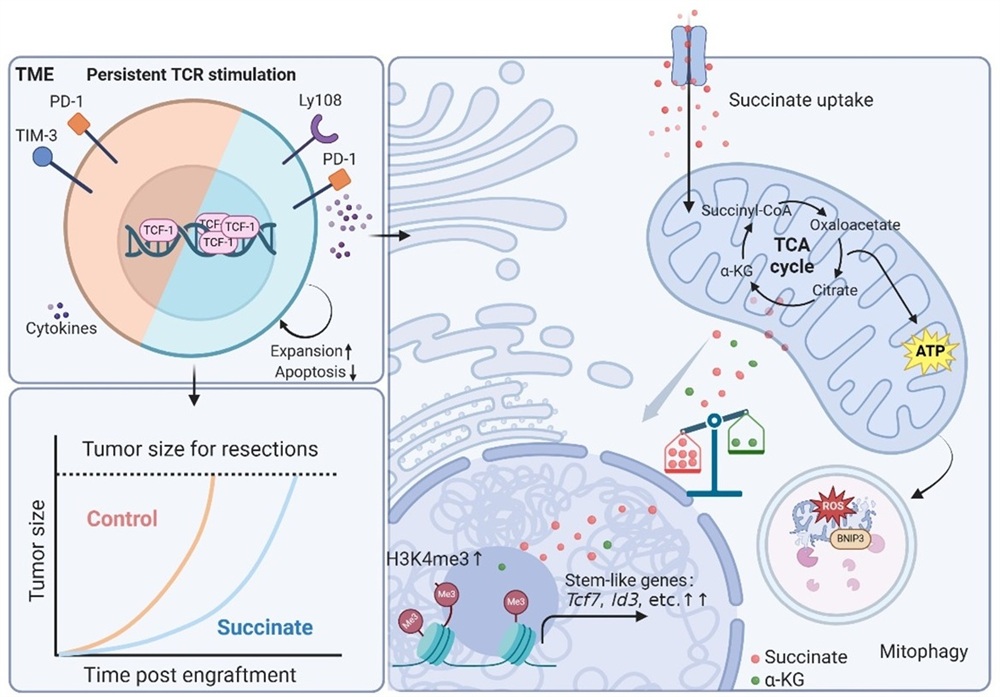
该研究系统揭示了琥珀酸通过非受体依赖的代谢适应与表观遗传重塑机制增强CD8⁺ T细胞的抗肿瘤免疫功能,并证实其诱导的干性T细胞兼具持久维持能力与响应免疫检查点阻断的动态分化潜能。这一发现不仅深化了对肿瘤微环境中代谢 – 免疫互作机制的理解,也为优化过继细胞疗法及联合免疫检查点阻断策略提供了新的理论依据与干预策略。
苏州系统医学研究所张连军、李贵登、顾志敏及瑞士洛桑大学Ping-Chih Ho为该论文的共同通讯作者。马凯丽、程洪成、王琳、刘沣华及新加坡南洋理工大学肖韩为该论文的共同第一作者。该研究得到国家自然科学基金、中国医学科学院创新工程、国家生物药技术创新中心CGT平台等项目的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S1074761325003267
肿瘤抗原特异性CD8⁺ T细胞是抗肿瘤免疫的核心执行者,然而在肿瘤微环境中其功能常因终末耗竭而受限。研究表明,T细胞的耗竭分化具有异质性,其中肿瘤引流淋巴结及肿瘤微环境中具有“干性样”特征的耗竭前体 T 细胞(Tpex)是维持长期免疫记忆及响应免疫检查点治疗的关键群体。然而,如何维持T细胞干性仍是肿瘤免疫领域内尚未解决的重要科学问题。T细胞的活化、分化与功能状态受到免疫信号与代谢信号的双重精密调控。琥珀酸作为三羧酸循环中的关键中间代谢物,在琥珀酸脱氢酶(SDH)突变型肿瘤中异常累积,但其在CD8⁺ T细胞介导的抗肿瘤免疫中的作用尚存争议,尤其是对于 T 细胞分化状态是否有直接调控作用还不清楚。因此,深入阐明琥珀酸对CD8⁺ T细胞功能分化的调控及机制,不仅有助于澄清现有争议,更对理解代谢微环境塑造T细胞免疫应答的理论框架及开发靶向代谢的免疫干预策略具有关键意义。
团队首先利用琥珀酸脱氢酶B亚基(SDHB)缺陷肿瘤模拟内源性琥珀酸富集肿瘤微环境,发现SDHB敲除可显著抑制肿瘤生长,并伴随肿瘤抗原特异性CD8⁺ T细胞数量上升,联合aPD-L1治疗可进一步增强该抗肿瘤免疫反应,而清除CD8⁺ T细胞则完全消除该效应,提示琥珀酸通过增强CD8⁺ T细胞功能发挥抗肿瘤作用。分析过继T细胞显示琥珀酸富集在促进T细胞增殖的同时抑制其凋亡。结合体外转录组测序分析,本研究证实琥珀酸的长期暴露促进T细胞“干性样”分化。机制研究揭示琥珀酸通过双重通路重塑T细胞功能:一方面,其通过增强OXPHOS活性与线粒体备用呼吸能力,并上调BNIP3介导的线粒体自噬以抑制mtROS积累与细胞凋亡;另一方面,通过调控组蛋白修饰(上调H3K4me3)促进干性相关基因(如Tcf7)的染色质开放与转录激活,进而诱导TCF-1等高表达和“干性样”CD8⁺ T细胞分化。进一步的功能验证表明,琥珀酸预处理的CD8⁺ T细胞在体内展现出显著增强的干性维持能力。在急性感染模型中,其分化轨迹明显偏向记忆表型,形成更多记忆前体效应细胞(MPECs)和中心记忆T细胞(TCM),并持续表达较高水平的TCF-1;在肿瘤过继治疗模型中,该潜能赋予T细胞更强的肿瘤控制能力,显著延长小鼠生存期并有效延缓终末耗竭进程。同样,经琥珀酸预处理的小鼠及人源CAR-T细胞在过继转移后均表现出更优的体内持久性与肿瘤清除效果。此外,转化研究显示基于公共转录组构建的肿瘤琥珀酸富集特征在一些黑色素瘤与胃癌队列中与免疫检查点抑制剂疗效及预后显著正相关,提示其作为一种新型预测性生物标志物的潜在价值。

图 琥珀酸促进CD8+ T细胞干性增强其抗肿瘤功能的分子机制
该研究系统揭示了琥珀酸通过非受体依赖的代谢适应与表观遗传重塑机制增强CD8⁺ T细胞的抗肿瘤免疫功能,并证实其诱导的干性T细胞兼具持久维持能力与响应免疫检查点阻断的动态分化潜能。这一发现不仅深化了对肿瘤微环境中代谢 – 免疫互作机制的理解,也为优化过继细胞疗法及联合免疫检查点阻断策略提供了新的理论依据与干预策略。
苏州系统医学研究所张连军、李贵登、顾志敏及瑞士洛桑大学Ping-Chih Ho为该论文的共同通讯作者。马凯丽、程洪成、王琳、刘沣华及新加坡南洋理工大学肖韩为该论文的共同第一作者。该研究得到国家自然科学基金、中国医学科学院创新工程、国家生物药技术创新中心CGT平台等项目的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S1074761325003267
