学术动态
李贵登团队《Nature》发现T细胞耗竭的新机制
作者:程洪成 来源自:中国免疫学会 点击数:1544 发布时间:2026-01-20
在癌症免疫治疗中,T细胞耗竭是导致临床上过继性细胞治疗(ACT)抵抗及免疫检查点抑制剂治疗(ICB)耐药的重要诱因。如何有效阻止或逆转T细胞向终末耗竭状态分化,是提升现有免疫治疗效果的关键科学挑战。解决这一问题的核心在于系统解析T细胞耗竭分化的调控网络及其关键节点。
肿瘤抗原触发的TCR信号是启动CD8⁺ T细胞抗肿瘤免疫应答的关键驱动力。然而,当该信号持续且反复激活时,会促使T细胞逐渐进入功能衰竭状态并失去效应能力。这一持续的TCR信号究竟通过何种分子机制被转译为耗竭程序,并最终决定T细胞命运?这是T细胞生物学领域长期悬而未决的重要科学问题。
2026年1月14日,中国医学科学院系统医学研究院/苏州系统医学研究所李贵登团队与Fred Hutchinson癌症研究中心的Philip D. Greenberg团队合作,在《Nature》和《Immunity & Inflammation》上同步发表题为“The Ubiquitin Ligase KLHL6 Drives Resistance to CD8⁺ T Cell Dysfunction”和“Chronic TCR Signaling-Driven Suppression of the FOXO1-KLHL6 Axis Promotes T Cell Exhaustion”的两篇研究论文。这两项研究揭示了持续TCR刺激通过抑制FOXO1的转录活性,导致E3泛素连接酶KLHL6的持续下调,这一分子事件正是驱动T细胞走向耗竭的关键开关。KLHL6的降低抑制了耗竭核心调控因子TOX以及线粒体稳态因子PGAM5的降解,从而启动耗竭程序并破坏线粒体功能,最终推动T细胞向终末耗竭状态分化并失去抗肿瘤能力。这一发现回答了“持续TCR信号如何驱T细胞耗竭”这一关键科学问题。更重要的是,KLHL6及其调控轴作为关键节点,为开发新型T细胞免疫治疗策略提供了极具潜力的新靶点,有望推动CAR-T、TCR-T等细胞免疫治疗进一步突破当前普遍面临的“耗竭瓶颈”。
为系统性鉴定调控T细胞耗竭的关键分子,研究团队通过整合分析来自病毒感染和肿瘤模型的CD8⁺ T细胞基因表达数据,利用计算生物学分析的方法,设计了一种基于计算分析指导的“双重”CRISPR筛选策略,成功鉴定出泛素化酶KLHL6是同时调控T细胞耗竭程序与细胞内能量代谢的关键因子。进一步研究发现,KLHL6的表达受到TCR信号的精密调控。短暂性TCR信号刺激会通过AKT-FOXO1通路暂时抑制KLHL6表达,但随后其表达会恢复正常。然而,在持续性TCR信号刺激下,KLHL6的表达被长期抑制并持续处于低水平,最终促使T细胞向终末耗竭分化。而KLHL6过表达能够通过维持Tpex细胞的自我更新和存活能力,有效阻止终末耗竭分化,实现持久抗肿瘤免疫应答。
为探究KLHL6调控T细胞耗竭分化的具体机制,研究团队利用E3底物泛素化标记结合质谱分析与生化实验验证,发现TOX和PGAM5是KLHL6的直接作用底物蛋白,在慢性感染或肿瘤微环境中,持续TCR信号通过抑制FOXO1的转录活性,引起KLHL6表达持续下调,进而削弱对TOX的泛素化降解,促使TOX积累,加速T细胞耗竭程序的启动并向终末耗竭表型分化。同时,KLHL6表达下调还会通过PGAM5-Drp1信号轴诱导线粒体过度分裂和呼吸功能损伤,进一步加剧T细胞耗竭程度。
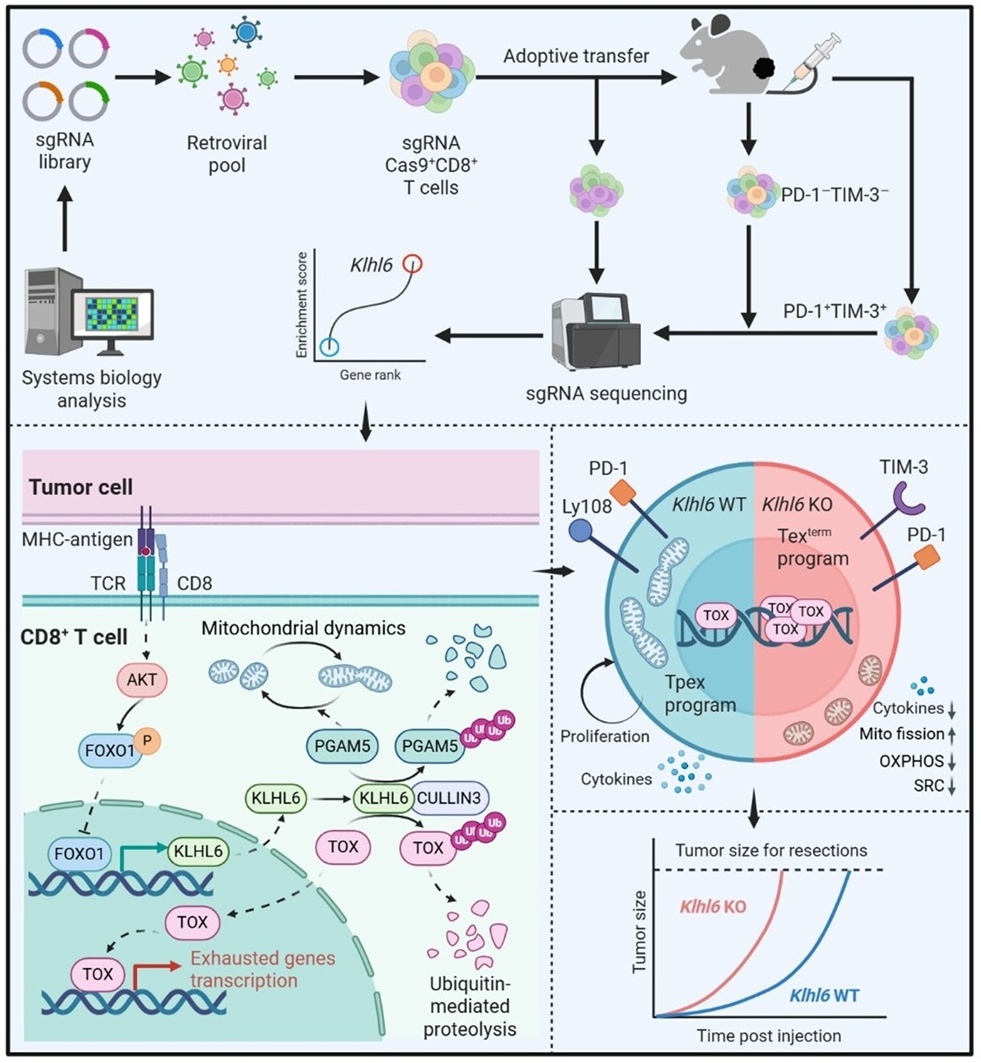
综上所述,这一基础生物学发现确立了泛素化酶KLHL6在慢性感染或肿瘤背景下调控T细胞功能的核心地位,并从机制层面阐明了持续抗原刺激如何通过TCR信号驱动耗竭程序。该研究凸显了泛素化降解与蛋白质稳态调控在决定T细胞命运和功能方面发挥的重要作用,为开发新型免疫治疗策略(如靶向TOX/PGAM5的蛋白降解剂或KLHL6激动剂)提供了极具潜力的新靶点和新思路。
苏州系统医学研究所李贵登研究员与Fred Hutchinson癌症研究中心Philip D. Greenberg教授为“The Ubiquitin Ligase KLHL6 Drives Resistance to CD8⁺ T Cell Dysfunction”(Nature)论文的共同通讯作者,苏州系统医学研究所副研究员程洪成、Fred Hutchinson癌症研究中心苏亚鹏博士及北京协和医学院博士研究生潘晓丽为该论文的共同第一作者。李贵登研究员与程洪成副研究员为“Chronic TCR Signaling-Driven Suppression of the FOXO1-KLHL6 Axis Promotes T Cell Exhaustion”(Immunity & Inflammation)论文的共同通讯作者,潘晓丽与苏州市立医院助理研究员潘雨佳为该论文的共同第一作者。该研究得到国家自然科学基金,科技部重大专项,江苏省自然科学基金以及中国医学科学院医学与健康科技创新工程等项目支持。
论文链接:https://doi.org/10.1038/s41586-025-09926-8
https://doi.org/10.1007/s44466-025-00023-z
肿瘤抗原触发的TCR信号是启动CD8⁺ T细胞抗肿瘤免疫应答的关键驱动力。然而,当该信号持续且反复激活时,会促使T细胞逐渐进入功能衰竭状态并失去效应能力。这一持续的TCR信号究竟通过何种分子机制被转译为耗竭程序,并最终决定T细胞命运?这是T细胞生物学领域长期悬而未决的重要科学问题。
2026年1月14日,中国医学科学院系统医学研究院/苏州系统医学研究所李贵登团队与Fred Hutchinson癌症研究中心的Philip D. Greenberg团队合作,在《Nature》和《Immunity & Inflammation》上同步发表题为“The Ubiquitin Ligase KLHL6 Drives Resistance to CD8⁺ T Cell Dysfunction”和“Chronic TCR Signaling-Driven Suppression of the FOXO1-KLHL6 Axis Promotes T Cell Exhaustion”的两篇研究论文。这两项研究揭示了持续TCR刺激通过抑制FOXO1的转录活性,导致E3泛素连接酶KLHL6的持续下调,这一分子事件正是驱动T细胞走向耗竭的关键开关。KLHL6的降低抑制了耗竭核心调控因子TOX以及线粒体稳态因子PGAM5的降解,从而启动耗竭程序并破坏线粒体功能,最终推动T细胞向终末耗竭状态分化并失去抗肿瘤能力。这一发现回答了“持续TCR信号如何驱T细胞耗竭”这一关键科学问题。更重要的是,KLHL6及其调控轴作为关键节点,为开发新型T细胞免疫治疗策略提供了极具潜力的新靶点,有望推动CAR-T、TCR-T等细胞免疫治疗进一步突破当前普遍面临的“耗竭瓶颈”。
为系统性鉴定调控T细胞耗竭的关键分子,研究团队通过整合分析来自病毒感染和肿瘤模型的CD8⁺ T细胞基因表达数据,利用计算生物学分析的方法,设计了一种基于计算分析指导的“双重”CRISPR筛选策略,成功鉴定出泛素化酶KLHL6是同时调控T细胞耗竭程序与细胞内能量代谢的关键因子。进一步研究发现,KLHL6的表达受到TCR信号的精密调控。短暂性TCR信号刺激会通过AKT-FOXO1通路暂时抑制KLHL6表达,但随后其表达会恢复正常。然而,在持续性TCR信号刺激下,KLHL6的表达被长期抑制并持续处于低水平,最终促使T细胞向终末耗竭分化。而KLHL6过表达能够通过维持Tpex细胞的自我更新和存活能力,有效阻止终末耗竭分化,实现持久抗肿瘤免疫应答。
为探究KLHL6调控T细胞耗竭分化的具体机制,研究团队利用E3底物泛素化标记结合质谱分析与生化实验验证,发现TOX和PGAM5是KLHL6的直接作用底物蛋白,在慢性感染或肿瘤微环境中,持续TCR信号通过抑制FOXO1的转录活性,引起KLHL6表达持续下调,进而削弱对TOX的泛素化降解,促使TOX积累,加速T细胞耗竭程序的启动并向终末耗竭表型分化。同时,KLHL6表达下调还会通过PGAM5-Drp1信号轴诱导线粒体过度分裂和呼吸功能损伤,进一步加剧T细胞耗竭程度。

综上所述,这一基础生物学发现确立了泛素化酶KLHL6在慢性感染或肿瘤背景下调控T细胞功能的核心地位,并从机制层面阐明了持续抗原刺激如何通过TCR信号驱动耗竭程序。该研究凸显了泛素化降解与蛋白质稳态调控在决定T细胞命运和功能方面发挥的重要作用,为开发新型免疫治疗策略(如靶向TOX/PGAM5的蛋白降解剂或KLHL6激动剂)提供了极具潜力的新靶点和新思路。
苏州系统医学研究所李贵登研究员与Fred Hutchinson癌症研究中心Philip D. Greenberg教授为“The Ubiquitin Ligase KLHL6 Drives Resistance to CD8⁺ T Cell Dysfunction”(Nature)论文的共同通讯作者,苏州系统医学研究所副研究员程洪成、Fred Hutchinson癌症研究中心苏亚鹏博士及北京协和医学院博士研究生潘晓丽为该论文的共同第一作者。李贵登研究员与程洪成副研究员为“Chronic TCR Signaling-Driven Suppression of the FOXO1-KLHL6 Axis Promotes T Cell Exhaustion”(Immunity & Inflammation)论文的共同通讯作者,潘晓丽与苏州市立医院助理研究员潘雨佳为该论文的共同第一作者。该研究得到国家自然科学基金,科技部重大专项,江苏省自然科学基金以及中国医学科学院医学与健康科技创新工程等项目支持。
论文链接:https://doi.org/10.1038/s41586-025-09926-8
https://doi.org/10.1007/s44466-025-00023-z
