学术动态
邝栋明团队揭示中性粒细胞迁移体线粒体重塑肿瘤干细胞命运
作者:邝栋明 来源自:中国免疫学会 点击数:130 发布时间:2026-02-13
2026年2月12日,邝栋明教授、魏瑗副教授团队联合劳向明主任医师在《Nature Cell Biology》在线发表研究论文“THY1+ cancer stem cells drive metastasis through a pseudohypoxic state shaped by neutrophil-derived mitochondria”,系统揭示了中性粒细胞通过迁移体依赖的线粒体转移,重塑肿瘤干细胞代谢状态并驱动转移的新机制。
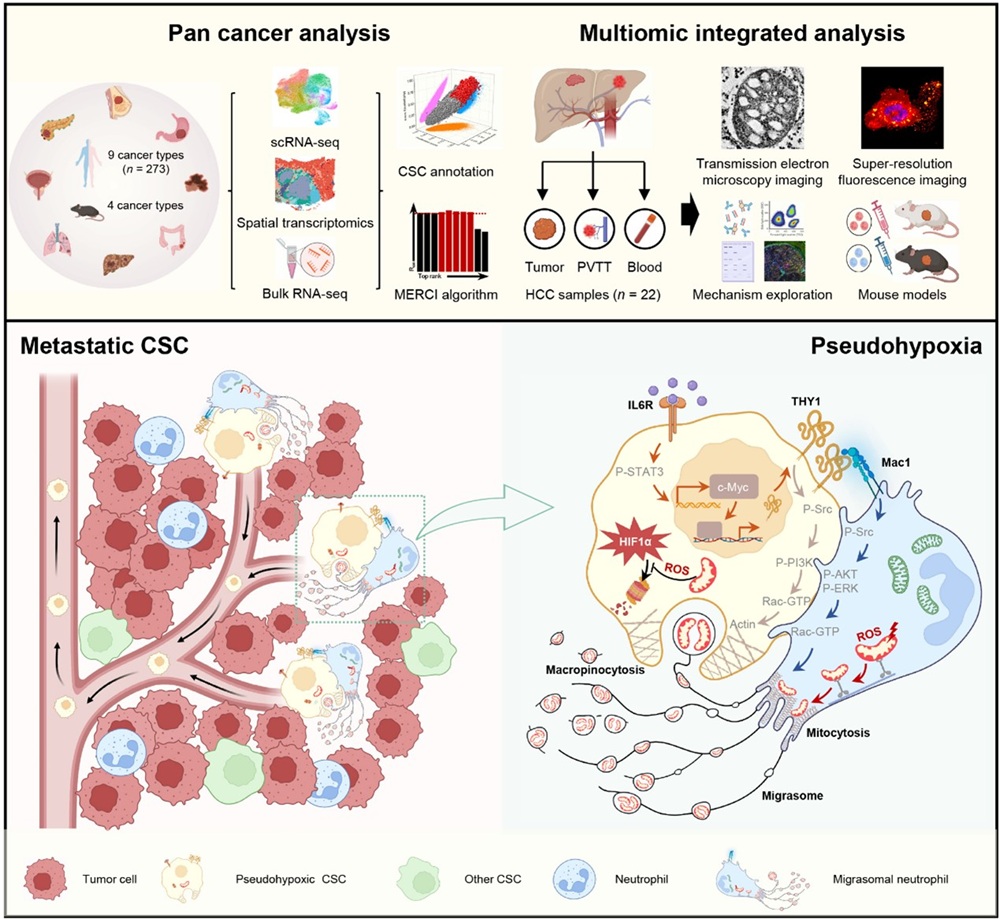
肿瘤转移的发生不仅依赖肿瘤细胞内在的遗传与表观遗传改变,也高度依赖肿瘤微环境中免疫细胞的调控。近年来,中性粒细胞在肿瘤转移中的功能逐渐受到关注,但其是否能够通过代谢性调控直接塑造肿瘤干细胞(Cancer stem cells, CSCs)的命运与状态,尚未得到系统阐明。该研究整合人类肿瘤单细胞转录组、空间转录组及泛癌分析数据,鉴定出一类具有显著转移优势的肿瘤干细胞亚群——THY1⁺ CSC。不同于经典HIF依赖的低氧反应,该亚群表现出一种非缺氧条件下形成的“伪缺氧”(pseudohypoxia)状态,并与远处转移密切相关。机制研究发现,在IL-6–Myc信号轴调控下,部分EpCAM⁺ CSC可向THY1⁺ CSC极化。更为重要的是,THY1⁺ CSC通过THY1–Mac1相互作用与肿瘤浸润中性粒细胞形成特异性通讯,诱导中性粒细胞以迁移体(migrasome)形式排出富含活性氧的损伤线粒体。随后,THY1⁺ CSC通过THY1介导的巨胞饮作用内化这些线粒体,从而在非低氧环境下建立稳定的伪缺氧代谢状态,增强侵袭与转移能力。功能实验进一步证实,阻断THY1–Mac1信号轴或抑制巨胞饮作用,均可显著削弱该伪缺氧状态及其介导的转移过程。
该研究在免疫学层面提出了三个重要认识:(1)揭示了中性粒细胞通过线粒体转移直接调控肿瘤干细胞命运的新模式;(2)建立了“免疫细胞来源线粒体—代谢重塑—肿瘤转移”这一跨细胞器调控轴;(3)拓展了中性粒细胞在肿瘤免疫中的功能维度,从炎症调节延伸至代谢重编程调控。该工作为理解免疫细胞如何塑造肿瘤干细胞可塑性提供了新的理论框架,也为开发靶向肿瘤转移的免疫调控策略提供了潜在干预靶点。
原文链接:https://www.nature.com/articles/s41556-026-01876-1

肿瘤转移的发生不仅依赖肿瘤细胞内在的遗传与表观遗传改变,也高度依赖肿瘤微环境中免疫细胞的调控。近年来,中性粒细胞在肿瘤转移中的功能逐渐受到关注,但其是否能够通过代谢性调控直接塑造肿瘤干细胞(Cancer stem cells, CSCs)的命运与状态,尚未得到系统阐明。该研究整合人类肿瘤单细胞转录组、空间转录组及泛癌分析数据,鉴定出一类具有显著转移优势的肿瘤干细胞亚群——THY1⁺ CSC。不同于经典HIF依赖的低氧反应,该亚群表现出一种非缺氧条件下形成的“伪缺氧”(pseudohypoxia)状态,并与远处转移密切相关。机制研究发现,在IL-6–Myc信号轴调控下,部分EpCAM⁺ CSC可向THY1⁺ CSC极化。更为重要的是,THY1⁺ CSC通过THY1–Mac1相互作用与肿瘤浸润中性粒细胞形成特异性通讯,诱导中性粒细胞以迁移体(migrasome)形式排出富含活性氧的损伤线粒体。随后,THY1⁺ CSC通过THY1介导的巨胞饮作用内化这些线粒体,从而在非低氧环境下建立稳定的伪缺氧代谢状态,增强侵袭与转移能力。功能实验进一步证实,阻断THY1–Mac1信号轴或抑制巨胞饮作用,均可显著削弱该伪缺氧状态及其介导的转移过程。
该研究在免疫学层面提出了三个重要认识:(1)揭示了中性粒细胞通过线粒体转移直接调控肿瘤干细胞命运的新模式;(2)建立了“免疫细胞来源线粒体—代谢重塑—肿瘤转移”这一跨细胞器调控轴;(3)拓展了中性粒细胞在肿瘤免疫中的功能维度,从炎症调节延伸至代谢重编程调控。该工作为理解免疫细胞如何塑造肿瘤干细胞可塑性提供了新的理论框架,也为开发靶向肿瘤转移的免疫调控策略提供了潜在干预靶点。
原文链接:https://www.nature.com/articles/s41556-026-01876-1
上一篇:no!
