学术动态
黄波团队揭示糖原-磷酸戊糖通路维持T细胞记忆的底层逻辑
作者:周雅博 来源自:中国免疫学会 点击数:5807 发布时间:2025-06-16
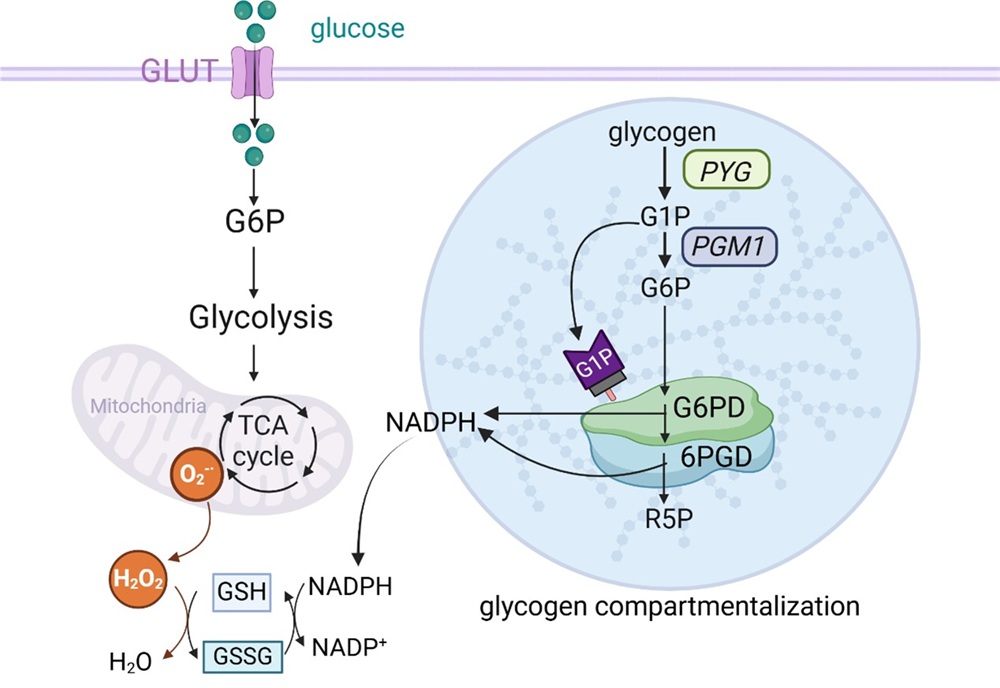
传统观点认为,磷酸戊糖途径(PPP)所催化的底物分子6-磷酸葡萄糖(G6P)来自于己糖激酶对葡萄糖的磷酸化。然而,中国医学科学院基础医学研究所黄波团队研究发现只有糖原分解产生的G6P而非葡萄糖磷酸化衍生的G6P才流向PPP,从而颠覆了现有教科书的认知。该工作于2025年6月10日,在国际权威期刊《分子细胞》(Molecular Cell)以题为“Glucose-1-phosphate promotes compartmentalization of glycogen with the pentose phosphate pathway in CD8+ memory T cells”在线发表。
这项工作的生物学意义何在?细胞依赖能量分子ATP而生,但受活性氧ROS破坏而死。尽管能量代谢的基本过程早已被阐明,但细胞依赖何种代谢途径清除活性氧(ROS),由死向生这一根本性问题,一直不清楚。黄波团队前期揭示,磷酸戊糖途径 (PPP) 是记忆性T细胞内生成NADPH的主要途径,NADPH通过还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)的循环,将2个H原子转交给H2O2(细胞内ROS的主要形式),生成2分子的H2O,从而清除胞内ROS。因此, 对PPP的调控直接关乎细胞的存亡。
与己糖激酶催化葡萄糖磷酸化相比较,糖原分解产生G6P过程中,首先生成G1P,后者再转化为G6P。研究团队通过点击化学、同位素示踪等技术发现G1P特异性结合PPP的初始酶葡萄糖-6-磷酸脱氢酶(G6PD),促进该酶分子形成多聚体,这一别构效应显著增强G6PD酶活,并驱动G6PD与糖原共定位,形成动态相分离(一种液滴结构)。这种由G1P诱导的液-液相分离还进一步招募PPP相关酶类,形成 “级联反应流水线”,使得PPP高效运转产生NADPH,确保对记忆性T细胞中ROS及时清除,细胞得以长期存活。这一发现通过G1P作为“变构信号”精准调控酶活性和代谢活动的空间分布,解释了为何糖原分解来源的G6P优先进入PPP,而葡萄糖磷酸化衍生的G6P显然不具备这样的能力,难以启动PPP。
这项工作还具有重要的病理生理意义和临床转化价值。T细胞过继疗法是肿瘤免疫治疗的重要手段,外源补充G1P的纳米颗粒(G1P-NPs)显著增加肿瘤引流淋巴结抗原特异性记忆CD8+ T细胞比例,增强抗肿瘤免疫。在黑色素瘤和肺癌小鼠模型中,靶向递送G1P的纳米颗粒使肿瘤浸润CD8+ T细胞的耗竭标志物表达显著下降,抗肿瘤IFN-γ、TNFα效应分子水平大幅提升,显著抑制肿瘤生长并延长小鼠生存期。在黑色素瘤患者来源的异种移植(PDX)模型中,G1P联合CAR-T治疗使肿瘤体积缩小70%,显著优于单一CAR-T疗法,重要的是,G1P是人体内的能量分子,体外能够大量合成,更加凸显其临床转化潜力。
本研究工作得到国家自然科学基金委基础科学中心项目及科技部重点研发计划的资助,以及重大疾病共性机制研究全国重点实验室的支持下完成。黄波教授为论文通讯作者,课题组助理研究员周雅博、直博生张超颖为论文共同第一作者。中国医学科学院病原生物研究所崔胜研究员为小分子蛋白质对接以及结构分析,提供了关键的科学指导与技术支持。
论文链接:https://doi.org/10.1016/j.molcel.2025.05.019
这项工作的生物学意义何在?细胞依赖能量分子ATP而生,但受活性氧ROS破坏而死。尽管能量代谢的基本过程早已被阐明,但细胞依赖何种代谢途径清除活性氧(ROS),由死向生这一根本性问题,一直不清楚。黄波团队前期揭示,磷酸戊糖途径 (PPP) 是记忆性T细胞内生成NADPH的主要途径,NADPH通过还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)的循环,将2个H原子转交给H2O2(细胞内ROS的主要形式),生成2分子的H2O,从而清除胞内ROS。因此, 对PPP的调控直接关乎细胞的存亡。
与己糖激酶催化葡萄糖磷酸化相比较,糖原分解产生G6P过程中,首先生成G1P,后者再转化为G6P。研究团队通过点击化学、同位素示踪等技术发现G1P特异性结合PPP的初始酶葡萄糖-6-磷酸脱氢酶(G6PD),促进该酶分子形成多聚体,这一别构效应显著增强G6PD酶活,并驱动G6PD与糖原共定位,形成动态相分离(一种液滴结构)。这种由G1P诱导的液-液相分离还进一步招募PPP相关酶类,形成 “级联反应流水线”,使得PPP高效运转产生NADPH,确保对记忆性T细胞中ROS及时清除,细胞得以长期存活。这一发现通过G1P作为“变构信号”精准调控酶活性和代谢活动的空间分布,解释了为何糖原分解来源的G6P优先进入PPP,而葡萄糖磷酸化衍生的G6P显然不具备这样的能力,难以启动PPP。
这项工作还具有重要的病理生理意义和临床转化价值。T细胞过继疗法是肿瘤免疫治疗的重要手段,外源补充G1P的纳米颗粒(G1P-NPs)显著增加肿瘤引流淋巴结抗原特异性记忆CD8+ T细胞比例,增强抗肿瘤免疫。在黑色素瘤和肺癌小鼠模型中,靶向递送G1P的纳米颗粒使肿瘤浸润CD8+ T细胞的耗竭标志物表达显著下降,抗肿瘤IFN-γ、TNFα效应分子水平大幅提升,显著抑制肿瘤生长并延长小鼠生存期。在黑色素瘤患者来源的异种移植(PDX)模型中,G1P联合CAR-T治疗使肿瘤体积缩小70%,显著优于单一CAR-T疗法,重要的是,G1P是人体内的能量分子,体外能够大量合成,更加凸显其临床转化潜力。

本研究工作得到国家自然科学基金委基础科学中心项目及科技部重点研发计划的资助,以及重大疾病共性机制研究全国重点实验室的支持下完成。黄波教授为论文通讯作者,课题组助理研究员周雅博、直博生张超颖为论文共同第一作者。中国医学科学院病原生物研究所崔胜研究员为小分子蛋白质对接以及结构分析,提供了关键的科学指导与技术支持。
论文链接:https://doi.org/10.1016/j.molcel.2025.05.019
