学术动态
蔡志坚/沈颖颖团队揭示粪产碱菌及其来源的外膜囊泡诱导肠道生理性Th17细胞生成的机制
作者:蔡志坚 来源自:中国免疫学会 点击数:5522 发布时间:2025-06-23
肠道是人体Th17细胞最为富集的部位,这与肠道作为吸收营养的主要器官,每天需要接触大量外界抗原,包括各种病原微生物的特性息息相关。因为,Th17细胞在清除胞外菌和真菌及维持肠道粘膜屏障的完整性中具有重要作用。肠道菌群直接参与肠道Th17细胞的诱导。目前,主流观点认为分节丝状菌是诱导肠道Th17细胞的主要细菌。然而,分节丝状菌的生长条件极其苛刻,成人肠道是否有分节丝状菌的定值仍存在很大的争议。
2025 年 4 月 10 日,蔡志坚/沈颖颖团队,在《Immunity》发表了题为“A. faecalis induces intestinal T helper 17 cells by promoting E3 ubiquitin ligase Trim21-mediated E3 ubiquitin ligase Fbxw7 degradation”的研究论文,发现新的诱导肠道Th17细胞生成的细菌。
团队研究发现,E3泛素连接酶Fbxw7可通过降解JunB,减少JunB介导的Ahr转录,进而限制AhR介导的Th17细胞关键转录因子基因Rorc的转录,最终抑制Th17细胞分化。值得注意的是,肠固有层和肠系膜淋巴结来源的CD4+ T细胞中Fbxw7水平特异下调,这促进课题组探讨肠道菌群在调节CD4+ T细胞中Fbxw7水平的作用。不出所料,肠道菌群裂解物可直接抑制CD4+ T细胞中Fbxw7的水平。通过肠道菌群培养,16S RNA测序及无菌小鼠定植实验,课题组发现粪产碱菌是诱导肠道Th17细胞的主要细菌。通过进一步研究,课题组发现粪产碱菌的蛋白成分可以小G蛋白CDC42依赖的方式被CD4+ T细胞内吞,阻止E3泛素连接酶Trim21与其E2泛素结合酶的结合,抑制Trim21的自泛素化降解,导致Trim21蛋白在胞内的积累。随后,Trim21促进了Fbxw7的泛素化降解。此外,粪产碱菌分泌的外膜囊泡可通过巨胞饮而非CDC42依赖的方式进入CD4+ T细胞,并通过Trim21-Fbxw7轴促进Th17细胞的分化。
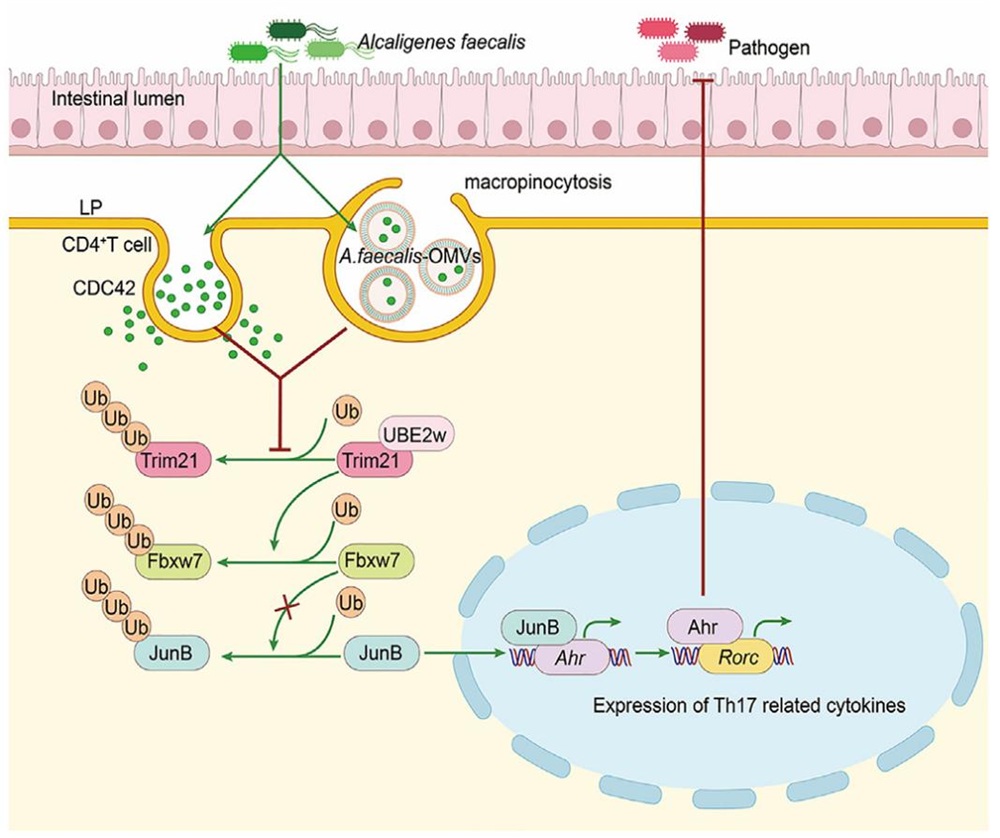
图1 粪产碱菌诱导肠道Th17细胞生成。在生理条件下,粪产碱杆菌可诱导肠道Th17细胞的生成。该菌的蛋白质通过CDC42途径或OMVs被CD4+ T细胞内吞后,会阻止Trim21蛋白发生自我泛素化降解。随后,Trim21通过抑制Fbxw7 介导的JunB降解,增强了JunB诱导的AhR转录,并进而增强了AhR诱导的RORγt转录,最终导致Th17细胞的分化生成。
粪产碱菌在人类生活环境中普遍存在,通过粪便检测,团队发现粪产碱菌在成人粪便的检出率为86%(86/100),而分节丝状菌在成人粪便的检出率为0%(0/100)。表明分节丝状菌作为诱导肠道Th17细胞主要细菌的观点很可能是一个生理悖论。相较于分节丝状菌,粪产碱菌更能合理解释Th17细胞在不同种族、年龄、性别及饮食习惯的人群肠道中的富集现象。
综上所述,该研究揭示了肠道菌群通过Trim21-Fbxw7轴诱导肠道Th17细胞生成的关键机制,不仅为肠道菌群如何诱导Th17细胞在大多数人群肠道中富集提供了更科学的解释,还首次报道了肠道菌群可通过直接调控CD4+ T细胞内源性分子,决定CD4+ T细胞分化的命运。此外,该研究还提出肠道菌群可以通过外膜囊泡与CD4+ T细胞进行交流,维持肠道免疫稳态的新概念。

图2 在生理条件下,粪产碱菌在诱导肠道Th17细胞方面起着关键作用。该研究发现粪产碱菌可减少Trim21的自身泛素化和降解,从而增加Trim21诱导的E3泛素连接酶Fbxw7的降解和JunB的积累,进而促进Ahr和Rorc基因的转录,最终增强肠道Th17细胞的分化。粪产碱菌诱导肠道Th17细胞对于肠道防御外部病原体和维持肠道稳态至关重要。该诱导过程被形象地比喻为一场交响乐:表演厅代表肠道微环境,粪产碱菌扮演指挥家的角色,初始CD4+ T细胞是表演者,而和谐的乐章则象征着Th17细胞分泌的效应分子。
浙江大学医学院附属邵逸夫医院特聘研究员沈颖颖、邵逸夫医院助理研究员马泽宇、浙江大学医学院八年制学生王涵靓及浙江大学附属儿童医院主任医师陈英虎为论文共同第一作者,浙江大学医学院免疫学研究所蔡志坚教授为论文通讯作者。该研究受到国家自然科学基金重项目及国家重点研发计划的支持。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00128-1
2025 年 4 月 10 日,蔡志坚/沈颖颖团队,在《Immunity》发表了题为“A. faecalis induces intestinal T helper 17 cells by promoting E3 ubiquitin ligase Trim21-mediated E3 ubiquitin ligase Fbxw7 degradation”的研究论文,发现新的诱导肠道Th17细胞生成的细菌。
团队研究发现,E3泛素连接酶Fbxw7可通过降解JunB,减少JunB介导的Ahr转录,进而限制AhR介导的Th17细胞关键转录因子基因Rorc的转录,最终抑制Th17细胞分化。值得注意的是,肠固有层和肠系膜淋巴结来源的CD4+ T细胞中Fbxw7水平特异下调,这促进课题组探讨肠道菌群在调节CD4+ T细胞中Fbxw7水平的作用。不出所料,肠道菌群裂解物可直接抑制CD4+ T细胞中Fbxw7的水平。通过肠道菌群培养,16S RNA测序及无菌小鼠定植实验,课题组发现粪产碱菌是诱导肠道Th17细胞的主要细菌。通过进一步研究,课题组发现粪产碱菌的蛋白成分可以小G蛋白CDC42依赖的方式被CD4+ T细胞内吞,阻止E3泛素连接酶Trim21与其E2泛素结合酶的结合,抑制Trim21的自泛素化降解,导致Trim21蛋白在胞内的积累。随后,Trim21促进了Fbxw7的泛素化降解。此外,粪产碱菌分泌的外膜囊泡可通过巨胞饮而非CDC42依赖的方式进入CD4+ T细胞,并通过Trim21-Fbxw7轴促进Th17细胞的分化。

图1 粪产碱菌诱导肠道Th17细胞生成。在生理条件下,粪产碱杆菌可诱导肠道Th17细胞的生成。该菌的蛋白质通过CDC42途径或OMVs被CD4+ T细胞内吞后,会阻止Trim21蛋白发生自我泛素化降解。随后,Trim21通过抑制Fbxw7 介导的JunB降解,增强了JunB诱导的AhR转录,并进而增强了AhR诱导的RORγt转录,最终导致Th17细胞的分化生成。
粪产碱菌在人类生活环境中普遍存在,通过粪便检测,团队发现粪产碱菌在成人粪便的检出率为86%(86/100),而分节丝状菌在成人粪便的检出率为0%(0/100)。表明分节丝状菌作为诱导肠道Th17细胞主要细菌的观点很可能是一个生理悖论。相较于分节丝状菌,粪产碱菌更能合理解释Th17细胞在不同种族、年龄、性别及饮食习惯的人群肠道中的富集现象。
综上所述,该研究揭示了肠道菌群通过Trim21-Fbxw7轴诱导肠道Th17细胞生成的关键机制,不仅为肠道菌群如何诱导Th17细胞在大多数人群肠道中富集提供了更科学的解释,还首次报道了肠道菌群可通过直接调控CD4+ T细胞内源性分子,决定CD4+ T细胞分化的命运。此外,该研究还提出肠道菌群可以通过外膜囊泡与CD4+ T细胞进行交流,维持肠道免疫稳态的新概念。

图2 在生理条件下,粪产碱菌在诱导肠道Th17细胞方面起着关键作用。该研究发现粪产碱菌可减少Trim21的自身泛素化和降解,从而增加Trim21诱导的E3泛素连接酶Fbxw7的降解和JunB的积累,进而促进Ahr和Rorc基因的转录,最终增强肠道Th17细胞的分化。粪产碱菌诱导肠道Th17细胞对于肠道防御外部病原体和维持肠道稳态至关重要。该诱导过程被形象地比喻为一场交响乐:表演厅代表肠道微环境,粪产碱菌扮演指挥家的角色,初始CD4+ T细胞是表演者,而和谐的乐章则象征着Th17细胞分泌的效应分子。
浙江大学医学院附属邵逸夫医院特聘研究员沈颖颖、邵逸夫医院助理研究员马泽宇、浙江大学医学院八年制学生王涵靓及浙江大学附属儿童医院主任医师陈英虎为论文共同第一作者,浙江大学医学院免疫学研究所蔡志坚教授为论文通讯作者。该研究受到国家自然科学基金重项目及国家重点研发计划的支持。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00128-1
