学术动态
黄波团队《Immunity》提出利用生物力学信号制备干性CAR-T细胞的新策略
作者:王殿恒 来源自:中国免疫学会 点击数:5063 发布时间:2025-08-11
2025年8月8日,中国医学科学院基础医学研究所黄波团队在《Immunity》发表了题为“Mechanical signaling via β2 integrin decouples T cell proliferation and differentiation for generating stem cell-like CAR T cells”的论文。研究报道了机械力信号磷酸化β2整合素,通过14-3-3ζ降解Yes相关蛋白(YAP),从而激活MafG上调干性相关基因,同时激活丝裂原活化蛋白激酶(MAPK)通路促进CAR-T细胞增殖。该机制通过解偶联T细胞增殖与分化,获得干性特征的CAR-T细胞。
团队深入探究了力学信号扩增干性CAR-T细胞其背后的机制,揭示出化学信号和生物力学信号本质性的区别。力学信号不仅有大小,而且有方向和频率,而化学信号仅有大小,没有方向和频率。团队发现生物力学信号导致CAR-T细胞膜表面受体β2整合素胞内段出现磷酸化,而化学信号却无此效果。磷酸化的β2整合素一方面促使机械力感受蛋白YAP的磷酸化,同时募集14-3-3ζ蛋白诱发磷酸化的YAP走向降解。这一关键性分子事件解除了YAP对转录因子MafG的转录抑制作用,使得MafG得以表达,进而转录激活SOX2、NANOG等干性基因。与此同时,磷酸化的β2整合素将力学信号进行转导,导致MAPK信号激活,促进CAR-T细胞增殖,从而清楚阐释生物力学信号是如何将增殖程序和分化程序分开,使得CAR-T细胞生长但不分化,并获得干性表型。
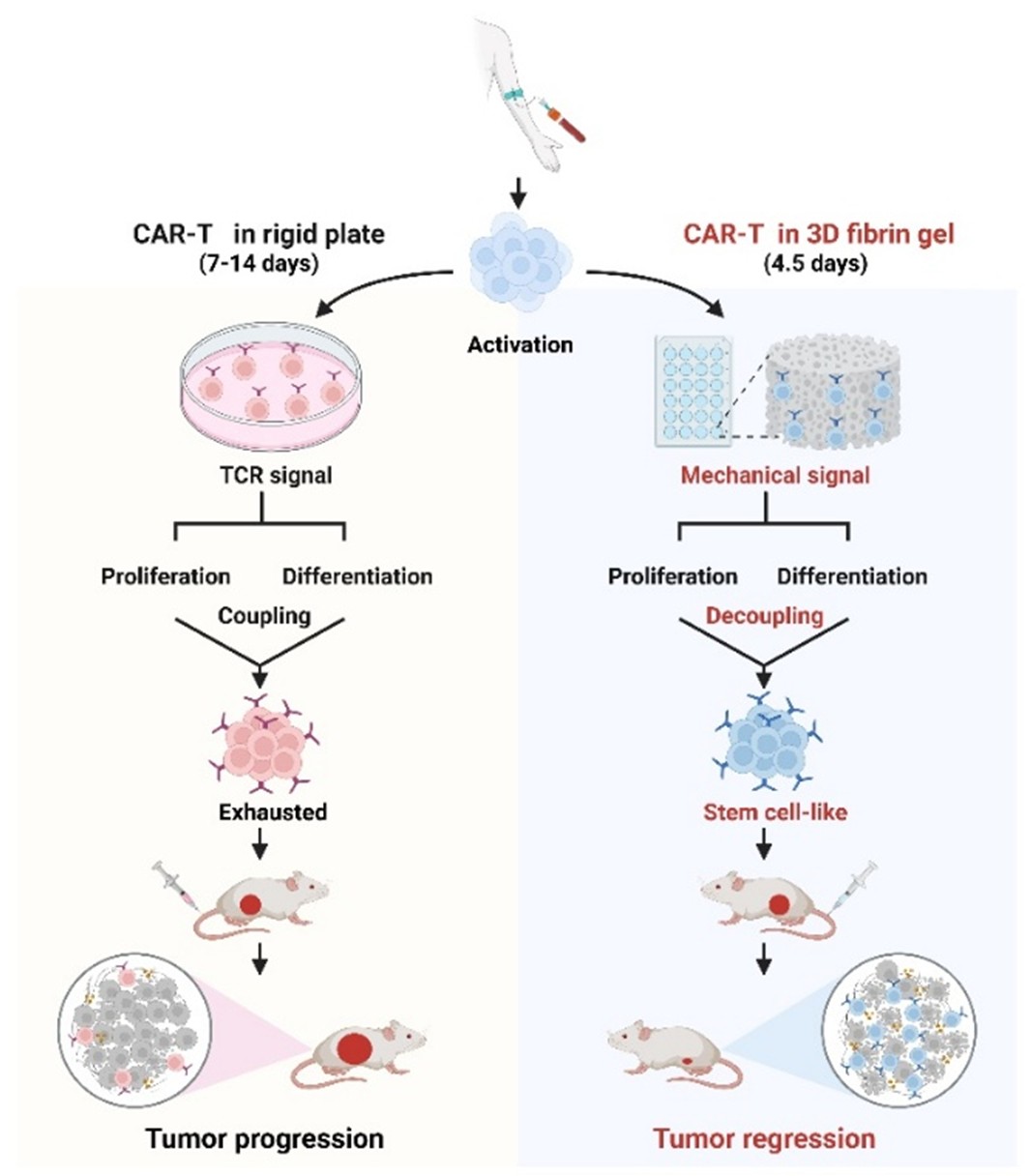
本研究同样具有重要的临床应用价值。CAR-T疗法作为肿瘤免疫治疗的重要手段,其疗效在很大程度上依赖于T细胞的肿瘤浸润情况与细胞功能状态。研究团队开发的生物力学信号制备干性CAR-T的新策略可显著提升CAR-T在肿瘤细胞内的浸润,从而增强抗肿瘤免疫反应。在多种癌症来源的荷瘤小鼠模型中,力学信号诱导的CAR-T细胞的抗肿瘤能力显著优于平板培养的CAR-T细胞。更重要的是,基于生物力学信号制备干性CAR-T的新策略,不仅制备周期短、细胞用量低,同时有效避免传统CAR-T治疗的毒副作用,将为CAR-T细胞治疗实体肿瘤提供全新方案。
本研究工作得到中国医学科学院医学与健康科技创新工程、基金委和科技部项目的资助,以及重大疾病共性机制研究全国重点实验室的支持下完成。黄波教授为论文通讯作者,课题组副研究员吕家迪、博士后王殿恒、博士生司甜为论文共同第一作者。中国医学科学院肿瘤医院张海增教授和郑州大学第一附属医院张毅教授,为本研究提供了临床样本和人源CAR-T质粒。
论文链接:https://doi.org/10.1016/j.immuni.2025.07.018
团队深入探究了力学信号扩增干性CAR-T细胞其背后的机制,揭示出化学信号和生物力学信号本质性的区别。力学信号不仅有大小,而且有方向和频率,而化学信号仅有大小,没有方向和频率。团队发现生物力学信号导致CAR-T细胞膜表面受体β2整合素胞内段出现磷酸化,而化学信号却无此效果。磷酸化的β2整合素一方面促使机械力感受蛋白YAP的磷酸化,同时募集14-3-3ζ蛋白诱发磷酸化的YAP走向降解。这一关键性分子事件解除了YAP对转录因子MafG的转录抑制作用,使得MafG得以表达,进而转录激活SOX2、NANOG等干性基因。与此同时,磷酸化的β2整合素将力学信号进行转导,导致MAPK信号激活,促进CAR-T细胞增殖,从而清楚阐释生物力学信号是如何将增殖程序和分化程序分开,使得CAR-T细胞生长但不分化,并获得干性表型。

本研究同样具有重要的临床应用价值。CAR-T疗法作为肿瘤免疫治疗的重要手段,其疗效在很大程度上依赖于T细胞的肿瘤浸润情况与细胞功能状态。研究团队开发的生物力学信号制备干性CAR-T的新策略可显著提升CAR-T在肿瘤细胞内的浸润,从而增强抗肿瘤免疫反应。在多种癌症来源的荷瘤小鼠模型中,力学信号诱导的CAR-T细胞的抗肿瘤能力显著优于平板培养的CAR-T细胞。更重要的是,基于生物力学信号制备干性CAR-T的新策略,不仅制备周期短、细胞用量低,同时有效避免传统CAR-T治疗的毒副作用,将为CAR-T细胞治疗实体肿瘤提供全新方案。
本研究工作得到中国医学科学院医学与健康科技创新工程、基金委和科技部项目的资助,以及重大疾病共性机制研究全国重点实验室的支持下完成。黄波教授为论文通讯作者,课题组副研究员吕家迪、博士后王殿恒、博士生司甜为论文共同第一作者。中国医学科学院肿瘤医院张海增教授和郑州大学第一附属医院张毅教授,为本研究提供了临床样本和人源CAR-T质粒。
论文链接:https://doi.org/10.1016/j.immuni.2025.07.018
