学术动态
季彤/樊嘉/周俭合作揭示肿瘤利用神经介导的跨器官通讯实现免疫逃逸
作者:季彤 来源自:中国免疫学会 点击数:4523 发布时间:2025-12-18
2025年10月24日,复旦大学附属中山医院季彤教授、樊嘉院士、周俭院士、孙云帆教授及上海交通大学医学院附属第九人民医院张陈平教授合作在《Cell》上发表了题为“Cancer cells co-opt an inter-organ neuroimmune circuit to escape immune surveillance”的研究论文。研究首次揭示了免疫压力下的肿瘤细胞,可“劫持”感觉神经远程抑制引流淋巴结(TDLN)中的系统性抗肿瘤免疫应答,从而实现免疫逃逸。阻断这种神经介导的肿瘤-TDLN通讯不仅显著增强免疫治疗疗效,也能显著抑制癌痛。
肿瘤是一种系统性疾病。肿瘤细胞能利用细胞内、细胞间、组织间、器官间等多尺度多层次事件逃逸机体的免疫杀伤。肿瘤如何利用肿瘤微环境(TME)中各组分进行免疫逃逸已被广泛研究。然而,肿瘤如何利用远隔组织/器官,在肿瘤宏环境(TMaE)尺度下实现免疫逃逸仍不清楚。
在生理及多种病理条件下,神经系统通过精细的神经环路和信号串扰,实现多系统、多器官间的协调反应,以瞬时或长期适应的方式维持机体稳态。神经系统与肿瘤的密切交互作用日益受到关注,并催生了新兴交叉领域—肿瘤神经学(Cancer Neuroscience)。其中,神经系统与免疫系统及内分泌代谢网络的动态互作,被证明在前列腺癌、胰腺癌、乳腺癌、头颈癌等多种肿瘤的发生、发展、转移及治疗抵抗中发挥关键作用,如季彤、张誉等人既往发现头颈癌肿瘤细胞在面临TME营养物质匮乏时可主动“劫持”感觉神经(nociceptive neuron)以维持自身旺盛的生长需求(Cell Metabolism封面,2022)。但是,目前肿瘤神经学研究多聚焦于TME尺度,对于TMaE尺度下的作用机制知之甚少。
研究人员首先通过两个头颈鳞状细胞癌(HNSCC)的临床队列,发现肿瘤组织中感觉神经富集,且高感觉神经丰度与患者更强的术前疼痛相关。通过单细胞转录组、空间转录组、CODEX、蛋白质组、CyTOF等技术,发现高感觉神经丰度促进患者肿瘤组织及外周血中的抑制性免疫景观。其中尤为显著的是:肿瘤相关巨噬细胞(TAM)与感觉神经在肿瘤组织中空间毗邻。通过构建头颈鳞癌、头颈黏膜黑色素瘤及头颈纤维肉瘤三种原位移植瘤小鼠模型与患者肿瘤组织验证,结合小鼠行为学、神经元钙成像、空间转录组及CUT&Tag等技术,研究人员发现:肿瘤组织中受到TAM压力的肿瘤细胞可以通过ATF4介导的SLIT2分泌激活支配肿瘤的感觉神经并产生疼痛。
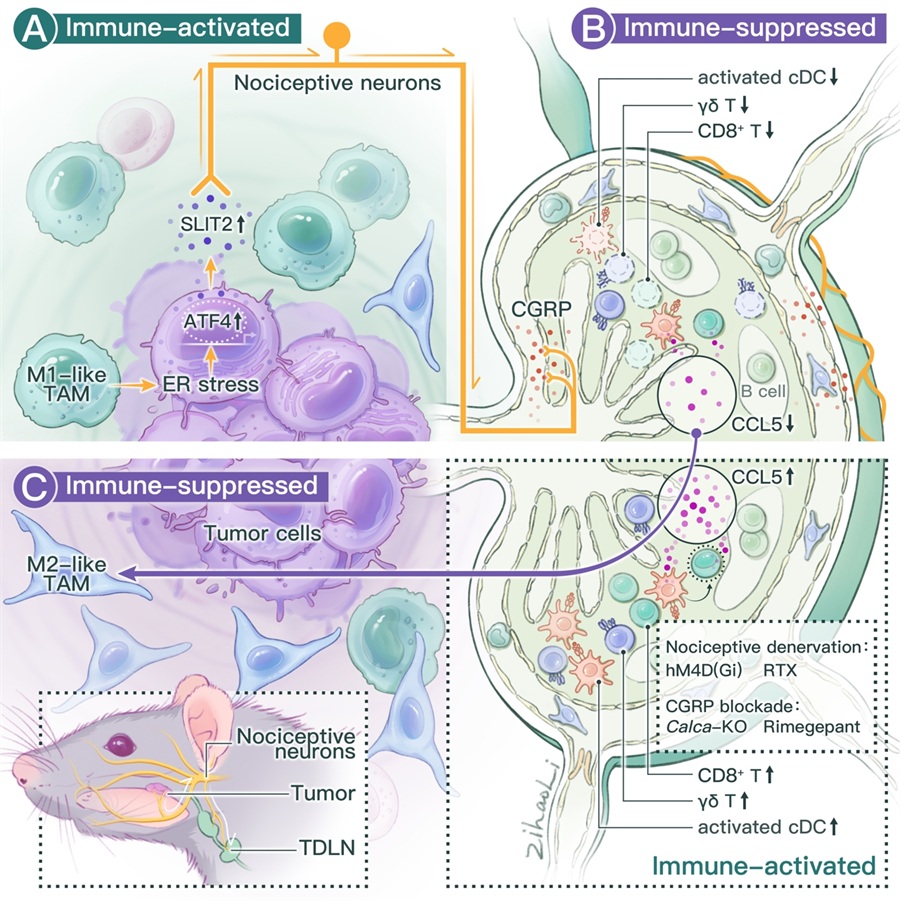
基于感觉神经元假单极的特性,研究人员推测在肿瘤组织中被激活的感觉神经可能间接影响了支配邻近组织的感觉神经。通过神经逆行示踪、感觉神经特异的化学遗传/光遗传调控小鼠、激光散斑成像等技术,结合多种体内过继回输模型,作者进一步发现:激活支配肿瘤的感觉神经可以进一步激活支配TDLN的感觉神经。更重要的是,激活TDLN的感觉神经可以免疫依赖的方式显著促进原发肿瘤的生长。
通过Stereo-seq、CyTOF、多色流式等技术,结合多种转基因小鼠模型与患者肿瘤组织验证,作者发现:被激活的支配TDLN的感觉神经,可通过分泌降钙素基因相关肽(CGRP)将TDLN重塑为免疫抑制状态,从而通过减少cDC介导的CD8+ T细胞激活抑制TDLN中CCL5的产生。TDLN中减少的CCL5可促进原发肿瘤中TAM的M2样极化从而使肿瘤细胞逃避免疫杀伤。基于上述细胞分子层面的探索,作者发现:使用国内外均已上市的偏头痛治疗药物CGRP受体抑制剂阻断感觉神经介导的肿瘤—TDLN通讯可以显著增强免疫治疗疗效并抑制癌痛,从而实现抑瘤与镇痛的双重作用。
复旦大学附属中山医院季彤教授、樊嘉院士、周俭院士、孙云帆教授及上海交通大学医学院附属第九人民医院张陈平教授为本文通讯作者。复旦大学附属中山医院“卓越住院医师”临床博士后张誉博士、郭毅波博士、复旦大学附属中山医院口腔颌面外科刘喆麒博士、上海交通大学医学院附属第九人民医院孙仪庭博士及杨溪主任医师为本文共同第一作者。中国科学院脑科学与智能技术卓越创新中心蒲慕明院士为本研究提供了特别支持。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(25)01129-8
肿瘤是一种系统性疾病。肿瘤细胞能利用细胞内、细胞间、组织间、器官间等多尺度多层次事件逃逸机体的免疫杀伤。肿瘤如何利用肿瘤微环境(TME)中各组分进行免疫逃逸已被广泛研究。然而,肿瘤如何利用远隔组织/器官,在肿瘤宏环境(TMaE)尺度下实现免疫逃逸仍不清楚。
在生理及多种病理条件下,神经系统通过精细的神经环路和信号串扰,实现多系统、多器官间的协调反应,以瞬时或长期适应的方式维持机体稳态。神经系统与肿瘤的密切交互作用日益受到关注,并催生了新兴交叉领域—肿瘤神经学(Cancer Neuroscience)。其中,神经系统与免疫系统及内分泌代谢网络的动态互作,被证明在前列腺癌、胰腺癌、乳腺癌、头颈癌等多种肿瘤的发生、发展、转移及治疗抵抗中发挥关键作用,如季彤、张誉等人既往发现头颈癌肿瘤细胞在面临TME营养物质匮乏时可主动“劫持”感觉神经(nociceptive neuron)以维持自身旺盛的生长需求(Cell Metabolism封面,2022)。但是,目前肿瘤神经学研究多聚焦于TME尺度,对于TMaE尺度下的作用机制知之甚少。
研究人员首先通过两个头颈鳞状细胞癌(HNSCC)的临床队列,发现肿瘤组织中感觉神经富集,且高感觉神经丰度与患者更强的术前疼痛相关。通过单细胞转录组、空间转录组、CODEX、蛋白质组、CyTOF等技术,发现高感觉神经丰度促进患者肿瘤组织及外周血中的抑制性免疫景观。其中尤为显著的是:肿瘤相关巨噬细胞(TAM)与感觉神经在肿瘤组织中空间毗邻。通过构建头颈鳞癌、头颈黏膜黑色素瘤及头颈纤维肉瘤三种原位移植瘤小鼠模型与患者肿瘤组织验证,结合小鼠行为学、神经元钙成像、空间转录组及CUT&Tag等技术,研究人员发现:肿瘤组织中受到TAM压力的肿瘤细胞可以通过ATF4介导的SLIT2分泌激活支配肿瘤的感觉神经并产生疼痛。

基于感觉神经元假单极的特性,研究人员推测在肿瘤组织中被激活的感觉神经可能间接影响了支配邻近组织的感觉神经。通过神经逆行示踪、感觉神经特异的化学遗传/光遗传调控小鼠、激光散斑成像等技术,结合多种体内过继回输模型,作者进一步发现:激活支配肿瘤的感觉神经可以进一步激活支配TDLN的感觉神经。更重要的是,激活TDLN的感觉神经可以免疫依赖的方式显著促进原发肿瘤的生长。
通过Stereo-seq、CyTOF、多色流式等技术,结合多种转基因小鼠模型与患者肿瘤组织验证,作者发现:被激活的支配TDLN的感觉神经,可通过分泌降钙素基因相关肽(CGRP)将TDLN重塑为免疫抑制状态,从而通过减少cDC介导的CD8+ T细胞激活抑制TDLN中CCL5的产生。TDLN中减少的CCL5可促进原发肿瘤中TAM的M2样极化从而使肿瘤细胞逃避免疫杀伤。基于上述细胞分子层面的探索,作者发现:使用国内外均已上市的偏头痛治疗药物CGRP受体抑制剂阻断感觉神经介导的肿瘤—TDLN通讯可以显著增强免疫治疗疗效并抑制癌痛,从而实现抑瘤与镇痛的双重作用。
复旦大学附属中山医院季彤教授、樊嘉院士、周俭院士、孙云帆教授及上海交通大学医学院附属第九人民医院张陈平教授为本文通讯作者。复旦大学附属中山医院“卓越住院医师”临床博士后张誉博士、郭毅波博士、复旦大学附属中山医院口腔颌面外科刘喆麒博士、上海交通大学医学院附属第九人民医院孙仪庭博士及杨溪主任医师为本文共同第一作者。中国科学院脑科学与智能技术卓越创新中心蒲慕明院士为本研究提供了特别支持。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(25)01129-8
