学术动态
刘传宇等团队《Science》发布千万级免疫细胞图谱,为AI时代大健康绘制“生命导航图”
作者:温婷婷 来源自:中国免疫学会 点击数:7035 发布时间:2026-01-13
人体内的免疫系统就像一支庞大而精密的“护卫队”,每一个免疫细胞都是一名独特的士兵,它们各司其职又紧密配合,守护着我们的健康。然而,长期以来,科学家们观察这个复杂的微观世界都像是隔着一层“毛玻璃”——虽然知道免疫细胞种类繁多,却难以看清每个细胞的具体特征和它们之间的调控关系。
2026年1月9日,华大生命科学研究院牵头建设的基因组多维解析技术全国重点实验室联合上海交通大学医学院附属瑞金医院、山西医科大学等多家机构在《Science》上发表了题为“Chinese Immune Multi-Omics Atlas”的文章。研究团队对428位中国自然人群队列中超过1000万个外周血免疫细胞进行了系统性多组学深度解析,绘制了高分辨率人群免疫多组学图谱(CIMA),这也是全球首个千万级免疫细胞图谱。这项研究如同一台“高清显微镜”,为深入理解免疫系统的运作逻辑提供了前所未有的精细视角,是生命数字化研究新范式的重要实践。
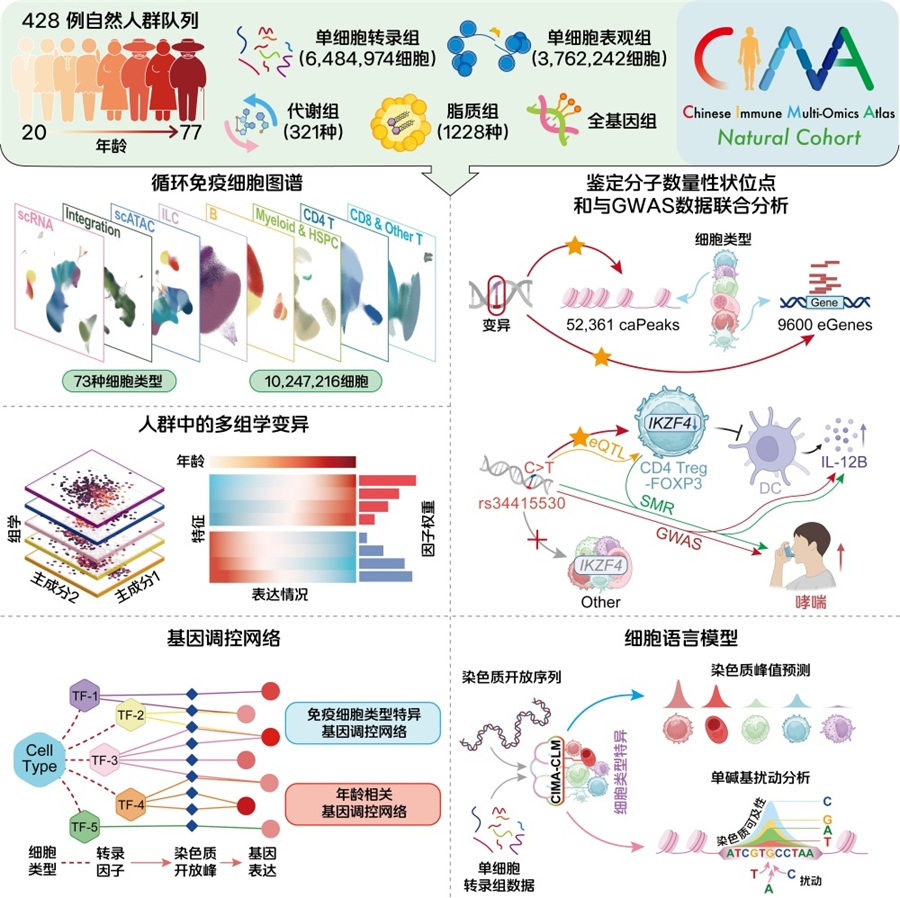
传统免疫学研究大多停留在主要细胞类型层面,就像只能区分免疫细胞中哪些是“陆军”,哪些是“海军”,而对内部更精细的兵种构成知之甚少。而CIMA则像是配备了一台高清显微镜,突破了以往视角的局限。
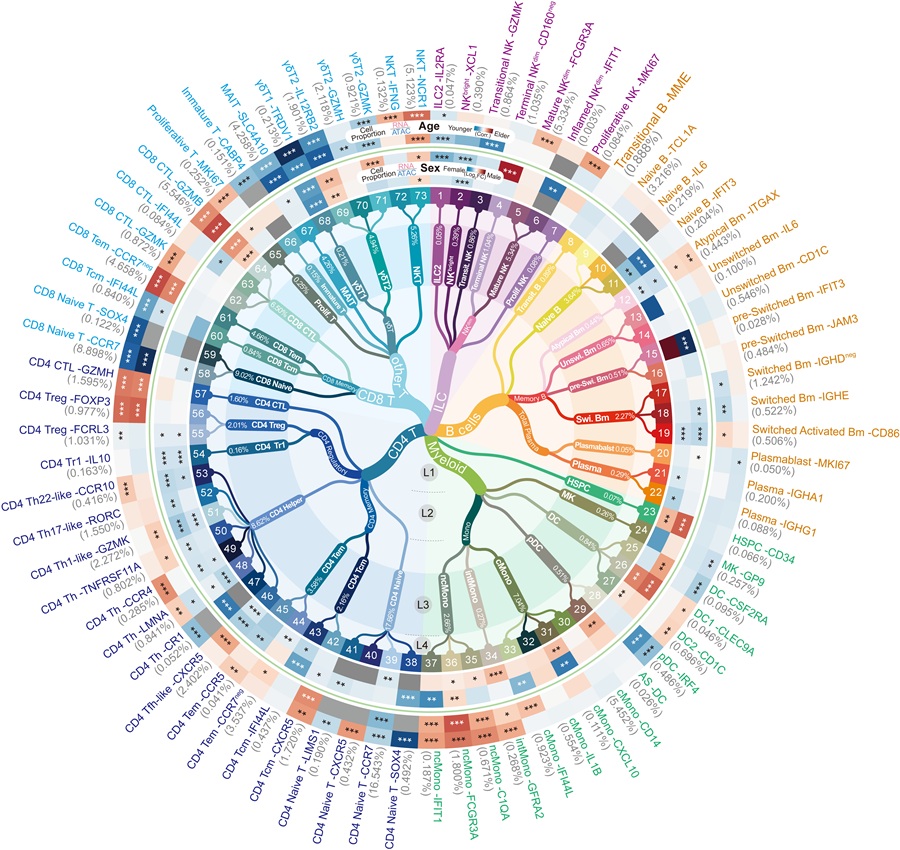
基于千万级的外周血免疫细胞的单细胞转录组、表观组数据,以及血浆脂质组、代谢组的多组学数据,研究团队成功鉴定出73种免疫细胞亚型,包括那些在血液中占比不足千分之一的罕见细胞。这些细胞虽然数量稀少,却在特定免疫应答中发挥着关键作用。以往的研究方法很难捕捉到这些稀有细胞,而本研究借助千万规模的单细胞数据,终于让这些“神秘士兵”露出了真容。研究团队为每种细胞建立了详细的“身份证”,记录了它们的分布及基因表达特征,并且结合了志愿者的生理数据,探索了年龄和性别等因素与特定免疫细胞特征的关联。
如果把不同类型的免疫细胞看作免疫大军的各个兵种,那么基因调控网络就是它们的“指挥系统”。依托高质量的单细胞多组学数据,研究团队绘制出了免疫细胞的基因调控图谱,揭示了转录因子如何精确指挥着1万多个靶基因的工作。
研究发现,不同的免疫细胞类型拥有独特的调控模式,而且这个“指挥系统”还具有很强的适应性,会随着衰老和性别调整策略。这解释了为什么老年人更容易感染某些疾病,也为理解男女在自身免疫性疾病上的差异提供了新线索。
同时,团队还将目光投向长期以来被称为基因组“暗物质”的非编码区域。这类区域虽然不直接编码蛋白质,却影响着基因是否被激活、以多大强度表达等。通过与全基因组测序数据相结合,研究团队发现了9600个受遗传调控的基因和超过5万个染色质开放区域。其中近三分之一的调控效应具有细胞类型特异性——同一个“基因开关”在不同细胞中扮演着不同的角色。这为理解“同一个基因变异为何与多种疾病相关”提供了关键证据。研究团队还发现免疫细胞的调控系统具有显著的动态性,在B细胞和单核细胞分化过程中,近半数的遗传调控效应会随着细胞状态改变而动态变化。
我们每个人身上都带有一定的遗传变异,但究竟哪些变异真的影响免疫系统和疾病?过去我们知道某些位点与疾病有关,但中间的机制却不一定清楚。
研究团队整合了154种分子和疾病性状的数据,在68种免疫细胞中发现了1196个显著的遗传关联。其中,73.2%的关联仅存在于特定细胞类型。这意味着,我们不仅知道“哪个变异与某种疾病相关”,还可以利用这张“高清导航图”,进一步回答这个变异主要是在哪一类免疫细胞里发挥作用,以及是通过影响哪个基因、哪条通路,改变了疾病风险。
以哮喘为例,研究揭示了一个关键变异如何在特定的调节性T细胞中调控某个基因的表达,进而影响炎症因子水平,最终提高个体的哮喘风险。这个发现不仅解释了该位点影响哮喘易感性的机制,也为未来开发精准治疗策略提供了方向。研究还发现,超过三分之二的疾病相关变异具有细胞类型特异性,这意味着要真正理解疾病机制,必须要在正确的细胞类型中寻找答案。
而面对海量的非编码变异,如何快速判断它们的功能?研究团队开发了一种创新的AI解决方案——CIMA细胞语言模型。这个工具就像一位精通基因语言的“预言家”,能够准确预测染色质可及性,评估非编码变异可能带来的功能影响,为疾病机制研究和药物靶点发现提供智能辅助。在32种免疫细胞的测试中,该模型表现出非常高的准确度,并成功预测出多个疾病相关非编码变异的功能效应。
该研究框架也体现了将细胞图谱分析与更通用的基因组基础大模型(如Genos)进行关联与整合的潜力。这种融合旨在构建从DNA序列到细胞功能的多层次、可解释的智能预测框架,为理解生命调控机制和加速生物医学发现开辟了新路径。
本研究是华大集团“133111i”精准健康研究新范式的成功示范。通过整合单细胞转录组、表观组、血浆代谢组、脂质组等多维度信息及生理表征,该研究构建了免疫健康的多组学基线,实现了对复杂生命系统的数字化解析与精准洞察,将赋能疾病预防与健康管理。同时,CIMA系列研究也是百亿细胞10BC计划的重要组成部分。
在此基础上,更大规模的CIMA二期计划已正式启动。其研究范围将从健康人群拓展至自身免疫性疾病、心血管疾病、感染性疾病等重大疾病队列,并重点应用Stereo-cell细胞组学技术和蛋白多重检测技术等新技术平台,旨在系统解析疾病发生发展的免疫学机制,挖掘新的诊疗靶点,并为构建更精确的“虚拟细胞”模型、实现疾病模拟与干预策略的数字化预测提供高质量数据资源。
基因组多维解析技术全国重点实验室刘传宇研究员、金鑫研究员、刘龙奇研究员、徐讯研究员和上海交通大学医学院附属瑞金医院曹亚南研究员为论文共同通讯作者。基因组多维解析技术全国重点实验室殷建华副研究员,中国科学院大学博士研究生郑宇辉、黄琢理、周雯雯,基因组多维解析技术全国重点实验室袁月博士、蔡鹏飞博士和白勇副研究员为该论文共同第一作者。该成果获得了国家重点研发计划、国家科技创新2030重大项目、国家自然科学基金、中国博士后科学基金、广东省基础与应用基础研究基金、杭州市生物医药与健康产业发展扶持科技专项,以及深圳市单细胞重点实验室、深圳市数字化细胞病理概念验证中心、山西医科大学-华大未来医学联合研究中心的支持。
本研究通过华大伦理委员会的审查批准,开展中严格遵循伦理规范和中华人民共和国人类遗传资源管理要求。
原文链接:https://www.science.org/doi/10.1126/science.adt3130
2026年1月9日,华大生命科学研究院牵头建设的基因组多维解析技术全国重点实验室联合上海交通大学医学院附属瑞金医院、山西医科大学等多家机构在《Science》上发表了题为“Chinese Immune Multi-Omics Atlas”的文章。研究团队对428位中国自然人群队列中超过1000万个外周血免疫细胞进行了系统性多组学深度解析,绘制了高分辨率人群免疫多组学图谱(CIMA),这也是全球首个千万级免疫细胞图谱。这项研究如同一台“高清显微镜”,为深入理解免疫系统的运作逻辑提供了前所未有的精细视角,是生命数字化研究新范式的重要实践。

突破一:从“雾里看花”到“精准定位”,给千万细胞发“身份证”
基于千万级的外周血免疫细胞的单细胞转录组、表观组数据,以及血浆脂质组、代谢组的多组学数据,研究团队成功鉴定出73种免疫细胞亚型,包括那些在血液中占比不足千分之一的罕见细胞。这些细胞虽然数量稀少,却在特定免疫应答中发挥着关键作用。以往的研究方法很难捕捉到这些稀有细胞,而本研究借助千万规模的单细胞数据,终于让这些“神秘士兵”露出了真容。研究团队为每种细胞建立了详细的“身份证”,记录了它们的分布及基因表达特征,并且结合了志愿者的生理数据,探索了年龄和性别等因素与特定免疫细胞特征的关联。

突破二:照亮基因组里的“暗物质”,破解细胞“指挥系统”运作密码
研究发现,不同的免疫细胞类型拥有独特的调控模式,而且这个“指挥系统”还具有很强的适应性,会随着衰老和性别调整策略。这解释了为什么老年人更容易感染某些疾病,也为理解男女在自身免疫性疾病上的差异提供了新线索。
同时,团队还将目光投向长期以来被称为基因组“暗物质”的非编码区域。这类区域虽然不直接编码蛋白质,却影响着基因是否被激活、以多大强度表达等。通过与全基因组测序数据相结合,研究团队发现了9600个受遗传调控的基因和超过5万个染色质开放区域。其中近三分之一的调控效应具有细胞类型特异性——同一个“基因开关”在不同细胞中扮演着不同的角色。这为理解“同一个基因变异为何与多种疾病相关”提供了关键证据。研究团队还发现免疫细胞的调控系统具有显著的动态性,在B细胞和单核细胞分化过程中,近半数的遗传调控效应会随着细胞状态改变而动态变化。
突破三:从疾病风险“精准地图” 到AI预言家
研究团队整合了154种分子和疾病性状的数据,在68种免疫细胞中发现了1196个显著的遗传关联。其中,73.2%的关联仅存在于特定细胞类型。这意味着,我们不仅知道“哪个变异与某种疾病相关”,还可以利用这张“高清导航图”,进一步回答这个变异主要是在哪一类免疫细胞里发挥作用,以及是通过影响哪个基因、哪条通路,改变了疾病风险。
以哮喘为例,研究揭示了一个关键变异如何在特定的调节性T细胞中调控某个基因的表达,进而影响炎症因子水平,最终提高个体的哮喘风险。这个发现不仅解释了该位点影响哮喘易感性的机制,也为未来开发精准治疗策略提供了方向。研究还发现,超过三分之二的疾病相关变异具有细胞类型特异性,这意味着要真正理解疾病机制,必须要在正确的细胞类型中寻找答案。
而面对海量的非编码变异,如何快速判断它们的功能?研究团队开发了一种创新的AI解决方案——CIMA细胞语言模型。这个工具就像一位精通基因语言的“预言家”,能够准确预测染色质可及性,评估非编码变异可能带来的功能影响,为疾病机制研究和药物靶点发现提供智能辅助。在32种免疫细胞的测试中,该模型表现出非常高的准确度,并成功预测出多个疾病相关非编码变异的功能效应。
该研究框架也体现了将细胞图谱分析与更通用的基因组基础大模型(如Genos)进行关联与整合的潜力。这种融合旨在构建从DNA序列到细胞功能的多层次、可解释的智能预测框架,为理解生命调控机制和加速生物医学发现开辟了新路径。
应用与展望:从科研范式走向健康未来
在此基础上,更大规模的CIMA二期计划已正式启动。其研究范围将从健康人群拓展至自身免疫性疾病、心血管疾病、感染性疾病等重大疾病队列,并重点应用Stereo-cell细胞组学技术和蛋白多重检测技术等新技术平台,旨在系统解析疾病发生发展的免疫学机制,挖掘新的诊疗靶点,并为构建更精确的“虚拟细胞”模型、实现疾病模拟与干预策略的数字化预测提供高质量数据资源。
基因组多维解析技术全国重点实验室刘传宇研究员、金鑫研究员、刘龙奇研究员、徐讯研究员和上海交通大学医学院附属瑞金医院曹亚南研究员为论文共同通讯作者。基因组多维解析技术全国重点实验室殷建华副研究员,中国科学院大学博士研究生郑宇辉、黄琢理、周雯雯,基因组多维解析技术全国重点实验室袁月博士、蔡鹏飞博士和白勇副研究员为该论文共同第一作者。该成果获得了国家重点研发计划、国家科技创新2030重大项目、国家自然科学基金、中国博士后科学基金、广东省基础与应用基础研究基金、杭州市生物医药与健康产业发展扶持科技专项,以及深圳市单细胞重点实验室、深圳市数字化细胞病理概念验证中心、山西医科大学-华大未来医学联合研究中心的支持。
本研究通过华大伦理委员会的审查批准,开展中严格遵循伦理规范和中华人民共和国人类遗传资源管理要求。
原文链接:https://www.science.org/doi/10.1126/science.adt3130
