学术动态
王锋团队《Immunity》揭示TCR-SUB1-DOCK2轴定量调控致病性CD4 T细胞组织浸润诱发自身免疫病的新机制
作者:王锋 来源自:中国免疫学会 点击数:1262 发布时间:2026-01-19
2026年1月13日,上海交通大学医学院王锋课题组在国际期刊《Immunity》发表了题为“The TCR-SUB1-DOCK2 Axis Promotes Autoimmunity by Driving Pathogenic CD4⁺ T Cell Tissue Infiltration”的研究论文。该研究系统阐明了TCR信号途径下游关键分子SUB1通过定量调控Dock2基因转录,驱动炎性CD4⁺ T细胞向病变组织浸润,从而诱发自身免疫疾病的全新机制。研究揭示SUB1作为调控致病性CD4⁺ T细胞组织迁移的“分子守门人”,为精准靶向免疫细胞迁移,治疗自身免疫病提供了潜在新策略。
自身免疫病发生发展的核心环节之一是活化炎性T细胞向特定组织的异常迁移与浸润,因此阻断该过程已成为极具前景的治疗策略之一。细胞迁移依赖细胞骨架动态重组,为细胞运动提供所需的机械力。然而,从T细胞受体 (TCR) 识别抗原到定量驱动细胞骨架重排、最终决定T细胞组织浸润能力的关键调节因子及信号通路,迄今仍未阐明。
基于前期临床数据的分析, 本研究团队发现SUB1在多种自身免疫病患者CD4⁺ T细胞中表达显著上调, 且其表达受TCR-IRF4信号轴直接调控。研究人员通过构建T细胞SUB1特异性敲除小鼠并诱导实验性自身免疫性脑脊髓炎(EAE),发现SUB1缺失可完全防止EAE发病, 并显著减少CD4⁺ T细胞的中枢神经系统(CNS)浸润。进一步整合多组学分析表明, SUB1缺失导致关键迁移调节因子DOCK2表达下调,进而抑制Rac依赖的肌动蛋白聚合, 最终削弱T细胞的迁移能力。深入的分子机制研究揭示,SUB1可通过液-液相分离 (LLPS) 形成生物分子凝聚体以打开特定染色质区域, 进而直接反式激活Junb转录,并与JUNB蛋白结合协同放大Dock2基因表达(图左)。
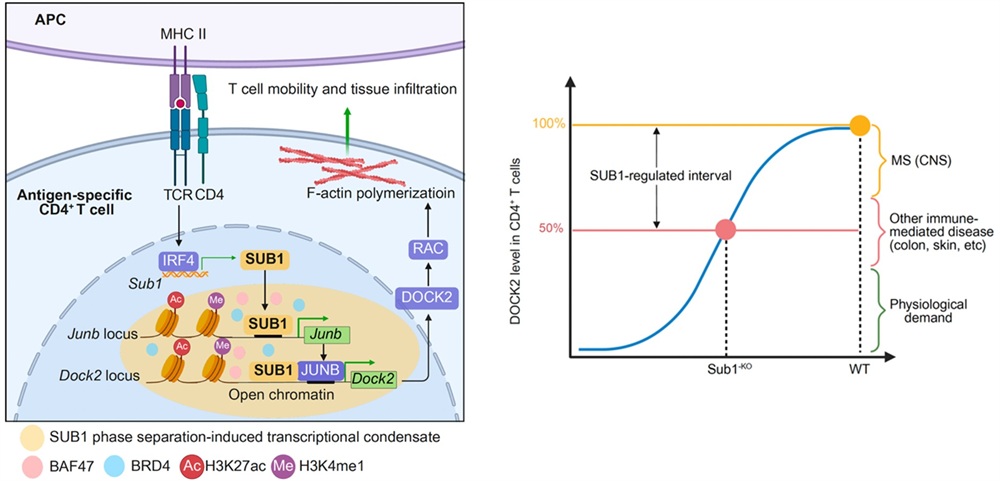
值得注意的是,CD4⁺ T细胞的SUB1缺失仅使DOCK2表达量下降约50%,因此SUB1轴对DOCK2的定量调控特性为自身免疫疾病的精准干预提供了重要契机:靶向SUB1可能实现一个最佳治疗窗口,在特异性阻断致病性CD4⁺ T细胞向炎症组织(包括中枢神经系统、肠道及皮肤等)浸润的同时, 最大程度地保留T细胞淋巴器官迁移生理功能及免疫防御作用 (图右)。综上,本研究阐明了一条连接TCR抗原识别信号与T细胞组织迁移的关键分子通路—TCR-SUB1-DOCK2轴,不仅深化了对自身免疫疾病发病机制的理解,也为开发聚焦细胞迁移途径的精准、安全免疫干预策略,提供了新的理论依据与潜在靶点分子。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00511-4
王锋,上海交通大学医学院/上海市免疫学研究所课题组长(PI)、研究员、博士生导师。 2005年本科毕业于北京师范大学,2010年获得北京生命科学研究所(NIBS)和北京师范大学联合培养博士学位。2010-2016年在斯坦福大学师从T细胞受体发现者Mark Davis院士进行博士后训练。长期致力于研究T细胞抗原识别和信号机制,以及抗原特异性T细胞在肿瘤等重大疾病免疫治疗中的作用。以通讯/第一作者在Immunity (2026)、Sci Immunol (2026)、JEM (2025)、PNAS (2018, 2020,2025)、EMBO J (2022)、Cell Discov (2021)、Nat Immunol (2016) 等国际期刊发表系列研究论文。以第一发明人申请国家/国际专利13项,开展实体瘤TCR-T免疫治疗临床试验。主持国家自然科学基金重点项目、免疫力解码专项和国家重点研发计划等10余项国家级及省部级课题。入选国家万人计划青年拔尖人才,东方学者特聘教授,上海市浦江人才和曙光学者。担任中国生物医药产业链创新与转化联盟核酸药物分会副主委、免疫治疗药物分会秘书长,中国免疫学会青年工作委员会常委,中国药理学会呼吸药理专委会常委以及上海市免疫学会中医药免疫专委会副主委。
自身免疫病发生发展的核心环节之一是活化炎性T细胞向特定组织的异常迁移与浸润,因此阻断该过程已成为极具前景的治疗策略之一。细胞迁移依赖细胞骨架动态重组,为细胞运动提供所需的机械力。然而,从T细胞受体 (TCR) 识别抗原到定量驱动细胞骨架重排、最终决定T细胞组织浸润能力的关键调节因子及信号通路,迄今仍未阐明。
基于前期临床数据的分析, 本研究团队发现SUB1在多种自身免疫病患者CD4⁺ T细胞中表达显著上调, 且其表达受TCR-IRF4信号轴直接调控。研究人员通过构建T细胞SUB1特异性敲除小鼠并诱导实验性自身免疫性脑脊髓炎(EAE),发现SUB1缺失可完全防止EAE发病, 并显著减少CD4⁺ T细胞的中枢神经系统(CNS)浸润。进一步整合多组学分析表明, SUB1缺失导致关键迁移调节因子DOCK2表达下调,进而抑制Rac依赖的肌动蛋白聚合, 最终削弱T细胞的迁移能力。深入的分子机制研究揭示,SUB1可通过液-液相分离 (LLPS) 形成生物分子凝聚体以打开特定染色质区域, 进而直接反式激活Junb转录,并与JUNB蛋白结合协同放大Dock2基因表达(图左)。

值得注意的是,CD4⁺ T细胞的SUB1缺失仅使DOCK2表达量下降约50%,因此SUB1轴对DOCK2的定量调控特性为自身免疫疾病的精准干预提供了重要契机:靶向SUB1可能实现一个最佳治疗窗口,在特异性阻断致病性CD4⁺ T细胞向炎症组织(包括中枢神经系统、肠道及皮肤等)浸润的同时, 最大程度地保留T细胞淋巴器官迁移生理功能及免疫防御作用 (图右)。综上,本研究阐明了一条连接TCR抗原识别信号与T细胞组织迁移的关键分子通路—TCR-SUB1-DOCK2轴,不仅深化了对自身免疫疾病发病机制的理解,也为开发聚焦细胞迁移途径的精准、安全免疫干预策略,提供了新的理论依据与潜在靶点分子。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00511-4
王锋,上海交通大学医学院/上海市免疫学研究所课题组长(PI)、研究员、博士生导师。 2005年本科毕业于北京师范大学,2010年获得北京生命科学研究所(NIBS)和北京师范大学联合培养博士学位。2010-2016年在斯坦福大学师从T细胞受体发现者Mark Davis院士进行博士后训练。长期致力于研究T细胞抗原识别和信号机制,以及抗原特异性T细胞在肿瘤等重大疾病免疫治疗中的作用。以通讯/第一作者在Immunity (2026)、Sci Immunol (2026)、JEM (2025)、PNAS (2018, 2020,2025)、EMBO J (2022)、Cell Discov (2021)、Nat Immunol (2016) 等国际期刊发表系列研究论文。以第一发明人申请国家/国际专利13项,开展实体瘤TCR-T免疫治疗临床试验。主持国家自然科学基金重点项目、免疫力解码专项和国家重点研发计划等10余项国家级及省部级课题。入选国家万人计划青年拔尖人才,东方学者特聘教授,上海市浦江人才和曙光学者。担任中国生物医药产业链创新与转化联盟核酸药物分会副主委、免疫治疗药物分会秘书长,中国免疫学会青年工作委员会常委,中国药理学会呼吸药理专委会常委以及上海市免疫学会中医药免疫专委会副主委。
